Разработка биопрепарата для защиты сои от грибных болезней в условиях Сибири
Содержание
Разработка биопрепарата для защиты сои от грибных болезней в условиях Сибири
Отчёт состоит из семи глав, введения, заключения, списка литературы, списка исполнителей, реферата. Текст изложен на 152 страницах, включает 14 таблиц, 74 рисунка, 89 цитированных источников, 5 приложений.
Ключевые слова: соя, грибные болезни, биологические препараты, биологические методы, антагонисты, защита растений.
Цель работы – разработка биопрепарата для защиты сои от грибных болезней в условиях Сибири. В ходе выполнения работы решены следующие задачи: создана коллекция вызывающих заболевания сои фитопатогенных грибов р.р. Fusarium, Alternaria, Phytium, Acremonium, Cladosporium, Rhizoctonia, актуальных для региона; из местных почвенных сообществ выделены 22 бактериальных штамма-антагониста, подавляющих рост возбудителей грибных болезней сои, актуальных для региона; проведены лабораторные и полевые испытания штаммов-антагонистов в качестве биологических агентов для защиты сои от грибных болезней; разработаны протоколы культивирования наиболее эффективных штаммов-антагонистов для получения пробных партий биопрепарата; показано, что в полевых условиях штаммы-антагонисты RSA-1 (р. Bacillus) и RSA-13 (р. Streptomyces) обеспечивают статистически значимое снижение интенсивности развития грибных болезней сои и обеспечивают статистически значимую прибавку урожая на 36-41%, не проявляют антагонизм в отношении симбиотических азотфиксирующих бактерий и не оказывают негативного воздействия на нодуляцию сои; установлено, что спектр антигрибной активности штаммов RSA-1 и RSA-13 распространяется на отделы Oomycota, Zygomycota, Ascomycota и Basidiomycota; разработана методика применения данных штаммов, что позволят усовершенствовать технологию возделывания сои в Приенисейской Сибири.
По результатам исследований штаммы RSA-1 и RSA-13 рекомендуются к применению в качестве биологических агентов для защиты сои от грибных болезней в Сибири; применение штаммов должно проводиться методом бактеризации семян споровыми суспензиями из расчёта 10 л суспензии с титром 10 7 спор/мл на 1 т семян.
Результаты исследований опубликованы в журнале перечня ВАК; в издании, индексируемом в базе данных Scopus; в двух изданиях, индексируемых в РИНЦ; представлены на четырёх международных и одной национальной конференции. Статья, опубликованная в журнале перечня ВАК, проиндексирована в базе Agris FAO. Проведена генетическая идентификация эффективных штаммов антагонистов для их дальнейшего патентного депонирования.
Введение
В мировом сельском хозяйстве соя культурная (Glycine max(L.) Merr.) является самой распространенной белково-масличной культурой. Россия по производству соевых бобов занимает 9-е место в мире, а валовый сбор по стране с 1990 по 2018 гг. увеличился на 461% [Hartman et al, 2011; Anderson et al., 2019; Food and Agricultural organization…, 2020]. В последние годы рост посевных площадей под этой культурой наблюдается и в Сибири. Так, только за период 2016–2017 гг. в Новосибирской области рост посевных площадей под соей увеличился более чем в 7 раз, в Красноярском крае – в 2,7 раза [Чураков, 2018]. В 2018 и 2019 г. тенденция к росту площади посева сои сохранилась.
Значительный ущерб посевам сои наносят фитопатогенные микроорганизмы, в первую очередь – возбудители грибных болезней [Hartman et al., 2011; Dean et al., 2012; Savary et al., 2019]. По разным оценкам, потери урожая сои от болезней могут достигать 20–50% [Hartman et al., 2011; Баранов, Махонин, 2014; Delaney et al, 2018]. В условиях Дальневосточного региона и лесостепи Западной Сибири наиболее вредоносными фитопатогенами являются представители р. Fusarium, вызывающие корневые гнили и фузариозный вилт [Горобей и др., 2011; Заостровных и др., 2018]. Кроме этого, соя поражается целым рядом других фитопатогенных грибов и грибоподобных протистов, при этом инфекция часто носит комплексный характер [Безмутко, Кожевникова, 2019; Безмутко и др., 2019].
Разнообразие видового состава возбудителей грибных болезней сои затрудняет поиск источников устойчивости к фитопатогенам [Курилова, 2010; Заостровных и др., 2018]. В этой связи наиболее эффективным способом защиты посевов сои от грибных болезней является предпосевная обработка семян фунгицидами [Grichar, 2013; Delaney et al., 2018]. Неуклонный рост химической нагрузки на агроценозы и способность вредных организмов вырабатывать резистентность к массово применяемым пестицидам актуализировали вопрос биологизации защиты растений сои от болезней путем замены химических препаратов на биопрепараты, создаваемые на основе микроорганизмов, проявляющих антагонизм в отношении возбудителей болезней [Курилова, 2010; Баранов, Махонин, 2014; Семыкин и др., 2016; Штерншис и др., 2016; O’Brien, 2017; Жаркова, Манылова, 2018].
Мировая практика показывает, что высокая эффективность биопрепаратов может быть достигнута только при использовании в их составе штаммов, адаптированных к местным почвенно-климатическим условиям [Vasebi et al., 2013; Thakkar A., Saraf, 2015; Amaria et al., 2016; Haddad et al., 2017; Butu et al., 2020].
Целью настоящей работы была разработка биопрепарата для защиты сои от грибных болезней в условиях Сибири на основе бактерий, выделенных из автохтонных микробных сообществ.
В соответствии с техническим заданием в ходе выполнения работы были решены следующие задачи:
- Создание микробиологической коллекции возбудителей болезней сои, актуальных для региона.
- Выделение автохтонных бактерий-антагонистов, подавляющих развитие фитопатогенных грибов.
- Генетическая идентификация наиболее эффективных штаммов-антагонистов, разработка протоколов их культивирования.
- Лабораторные испытания штаммов-антагонистов.
- Изучение фунгистатического эффекта в системе растение – патоген – штамм бактерий антагонистов – штамм микросимбионта в полевых условиях.
Результаты исследований были опубликованы в 1 статье в журнале, входящем в перечень ВАК при Минобрнауки России (Приложение 3); в 1 статье в издании, индексируемом в базе Scopus (Приложение 4); в 2 статьях в изданиях, входящих в РИНЦ (Приложение 5); доложены на международных и национальных конференциях. Статья, опубликованная в журнале, входящем в перечень ВАК, проиндексирована в базе Agris (см. Приложение 3).
1 Современное состояние проблемы
1.1 Соя как пищевая, кормовая и техническая культура
Соя культурная Glycine max (L.) Merr., травянистое однолетнее растение семейства Бобовые (Fabaceae), является самой распространенной сельскохозяйственной культурой среди зернобобовых и масличных культур.
Хотя родиной сои как культурного растения является Юго-Восточная Азия (Китай, Индия, Япония, Корея, Вьетнам, Индонезия), благодаря своей экологической пластичности соя распространилась далеко за пределы первоначального ареала и в настоящее время возделывается более чем в шестидесяти странах. В 2019/20 году валовой сбор сои в мире оценивается почти в 342 млн. т (прирост 31% к уровню 2009/10 года), а объем мировой торговли – почти в 152 млн. т (прирост 65% к уровню 2009/10 года). Указанный рост мирового производства сои обеспечивался как увеличением посевных площадей под этой культурой, так и ростом урожайности культуры.
Как пищевой продукт соя в первую очередь характеризуется высокой концентрацией белка, содержащего все незаменимые аминокислоты. Содержание белка в семенах сои колеблется от 27 до 68%. Как показывает мировая практика, соевый белок является наиболее высококачественным, самым распространенным и дешевым источником растительного белка. По качественному составу соевый белок близок к белкам мяса, яиц, молока, при этом усвояемость соевых белков достигает 70%. Соя является единственной культурой, использование которой в небольших количествах (150–260 г) может удовлетворить суточную потребность человека во всех аминокислотах при отсутствии других источников белка в рационе. Наряду с высоким содержанием белка в семенах сои, следует отметить экономичность его производства. Благодаря способности культуры ассимилировать атмосферный азот с помощью симбиотических ризобактерий, стоимость одной тонны переваримого белка в соевом шроте в 15–18 раз ниже, чем в зерне хлебных злаков, и во много раз ниже, чем в кормовых дрожжах и синтетическом белке. Способность к симбиотической фиксации азота ведёт к том, что при благоприятных условиях соя не только не выносит азот из почвы с урожаем и фитомассой, но, напротив, обогащает почву этим элементом, что при соответствующем севообороте позволяет выращивать другие культуры без использования дорогостоящих азотных удобрений.
Кроме высокого содержания белка, семена сои содержат до 16–27% жиров (масла). Масло сои состоит на 94–95% из триглицеридов жирных кислот, из которых ненасыщенные составляют 80–94%, насыщенных – 6–20%. Ненасыщенная часть масла включает следующие полиненасыщенные жирные кислоты: линолевую (С18НЗ2O2) – 48–64% всего жира, олеиновую (С18НЗ4O2) – 20–36%, линоленовую (С18НЗ0O2) – 1,5–3%. Среди этих кислот линолевая кислота является незаменимой, то есть не может быть синтезирована организмом человека и должна поступать с пищей. Комплекс насыщенных жирных кислот включает пальмитиновую (С16НЗ2O2) – 4–11%, стеариновую (С18НЗ6O2) – 3–7%, арахиновую – 0,41% и лигноцериновую –0,1%. Наибольшей биологической ценностью обладают полиненасыщенные жирные кислоты, в первую очередь – благодаря своей антиоксидантной активности. Благодаря высокому содержанию в семенах, лёгкости извлечения и ценным биологическим качествам, соевое масло занимает лидирующее положение в мире в производстве растительных жиров (50% от их общего объема).
Содержание углеводов (глюкозы, фруктозы, сахарозы, раффинозы, стахиозы, а также легко- и трудногидролизуемых полисахаридов в зерне сои относительно невелико (от 17 до 26%), что делает её ценным диетическим продуктом.
Кроме этого, соя содержит целый ряд биологически ценных веществ, включая фосфолипиды, изофлавоны, токоферолы, минеральные элементы, витамины Аl, Вl ,В2, В3, В6,С, Dl ,D2, D3, Е, РР, К.
Россия по производству соевых бобов занимает 9-е место в мире, а валовый сбор по стране с 1990 по 2018 гг. увеличился на 461%. В последние годы рост посевных площадей под этой культурой наблюдается и в Сибири. Так, только за период 2016–2017 гг. в Новосибирской области рост посевных площадей под соей увеличился более чем в 7 раз, в Красноярском крае – в 2,7 раза. В 2018-2020 г. тенденция к росту площади посева сои сохранилась.
Тем не менее, производство сои в России отстаёт от потребностей, в связи с чем Россия ежегодно импортирует значительный объем сои. Так, согласно анализу данных ФТС, импорт сои в РФ составляет порядка 2,2 млн. т, что составляет почти 62 % по отношению к отечественному валовому сбору сои. Основными поставщиками сои в Россию являются Бразилия и Парагвай.
Наряду с импортом сои, Россия экспортирует порядка 0,5 млн. т сои, главным образом – в Китай и Иран. Преимущественно экспортируется соя, произведённая на Дальнем Востоке.
Предполагается, что расширение производства сои в России позволит решить следующие задачи:
- расширение производства и снижение себестоимости традиционных продуктов массового питания, выпускаемых мясоперерабатывающей, молочной, кондитерской, хлебопекарной, масложировой и пищеконцентратной промышленностью;
- производство продуктов функционального питания, снижающих уровень сердечнососудистых, желудочно-кишечных, онкологических заболеваний, нарушений иммунного статуса, остеопороза, болезней печени, почек, болезней обмена веществ, в том числе диабета, и ряда других заболеваний;
- производство качественных продуктов для системы социального питания (дошкольного, школьного и студенческого; питания в больницах, санаториях, домах ветеранов, питание военнослужащих и т.д.) с учетом возрастных групп населения и условий труда;
- питание в зонах заражения радиоактивными веществами и в зонах с неблагоприятной экологической обстановкой;
- создание белковых модулей и БАДов длительного хранения для питания людей в экстремальных ситуациях и в зонах стихийных бедствий;
- создание БАДов и фитонутрицевтиков для фармакологической промышленности;
- производства высокобелковых биологически активных кормов и концентратов из сои для нужд животноводства, птицеводства, пушного звероводства, рыбного хозяйства.
Решение проблемы повышения производства сои в России должно осуществляться по двум направлениям – расширение зоны возделывания и повышение урожайности культуры, в первую очередь – за счёт снижения потерь от болезней [Тюрина, 2008; Hartman et al, 2011; Линников, 2018; Anderson et al., 2019; Чураков, 2018; Food and Agricultural organization…, 2020].
1.2 Грибные болезни сои
Как и все растения, соя подвержена целому комплексу грибных болезней. Консенсусный документ по биологии сои [Консенсусный…, 2000] в качестве возбудителей грибных болезней приводит следующий список (таблица 1.1)
Таблица 1.1 – Список возбудителей грибных болезней сои согласно Консенсусному документу по биологии сои.
| Заболевание | Возбудитель |
| Бурая пятнистость | Septoria glycines |
| Ложная мучнистая роса | Peronospora trifoliorum var. manshurica |
| Стеблевая гниль | Phialophora gregata или Acremonium strictum |
| Фитофтороз корней и стебля | Phytophthora megasperma |
| Стеблевой рак | Diaporthe phaseolorum var caulivora |
| Стеблевая и корневая гниль (ризоктониоз) | Rhizoctonia solani |
| Черная ножка | Pythium spp. |
| Фузариозное увядание | Fusarium spp. |
Анализ литературы [Kulkarni et al., 1976; Varma et al., 2015; Hartman et al., 2016; Заостровных и др., 2018; Безмутко и др., 2019] показывает, что этот список существенно шире (таблица 1.2).
Таблица 1.2 – Расширенный список возбудителей грибных болезней сои согласно литературным данным
| Альтернариоз | Alternaria spp. |
| Антракноз | Colletotrichum truncatum |
| Colletotrichum dematium f. truncatum | |
| Glomerella glycines | |
| Colletotrichum destructivum (анаморфа) | |
| Черная листовая пятнистость | Arkoola nigra |
| Черная корневая гниль | Thielaviopsis basicola |
| Chalara elegans (синанаморфа) | |
| Бурая пятнистость | Septoria glycines |
| Mycosphaerella usoenskajae (телеоморфа) | |
| Бурая стеблевая гниль | Phialophora gregata |
| Чёрная гниль | Macrophomina phaseolina |
| Хоанефороз листьев | Choanephora infundibulifera |
| Choanephora trispora | |
| Выпадение всходов | Rhizoctonia solani |
| Thanatephorus cucumeris (телеоморфа) | |
| Pythium aphanidermatum | |
| Pythium debaryanum | |
| Pythium irregulare | |
| Pythium myriotylum | |
| Pythium ultimum | |
| Ложная мучнистая роса, пероноспороз | Peronospora manshurica |
| Листовая пятнистость | Drechslera spp. |
| Листовая пятнистость | Bipolaris sorokiniana |
| Листовая пятнистость, церкоспороз | Cercospora sojina |
| Фузариозная корневая гниль | Fusarium spp. |
| Листовая пятнистость | Leptosphaerulina trifolii |
| Корневая гниль | Mycoleptodiscus terrestris |
| Корневая гниль | Neocosmospora vasinfecta |
| Acremonium spp. (анаморфа) | |
| Фомоз семян | Phomopsis spp. |
| Фитофотороз | Phytophthora sojae |
| Листовая пятнистость, филлостиктоз | Phyllosticta sojaecola |
| Техасская корневая гниль | Phymatotrichopsis omnivora |
| Диапортоз | Diaporthe phaseolorum |
| Phomopsis sojae (анаморфа) | |
| Мучнистая роса | Microsphaera diffusa |
| Пурпурный церкоспороз | Cercospora kikuchii |
| Красная листовая пятнистость | Pyrenochaeta glycines |
| Питиозная гниль | Pythium aphanidermatum |
| Pythium debaryanum | |
| Pythium irregulare | |
| Pythium myriotylum | |
| Pythium ultimum | |
| Красная корневая гниль | Cylindrocladium crotalariae |
| Calonectria crotalariae (телеоморфа) | |
| Красная пятнистость | Dactuliochaeta glycines |
| Dactuliophora glycines (синанаморфа) | |
| Ризоктониоз листьев | Rhizoctonia solani |
| Thanatephorus cucumeris (телеоморфа) | |
| Ризоктониозная стеблевая и корневая гниль | Rhizoctonia solani |
| Ржавчина | Phakopsora pachyrhizi |
| Парша | Spaceloma glycines |
| Стеблевая гниль | Sclerotinia sclerotiorum |
| Выпадение всходов и стеблевая гниль | Sclerotium rolfsii |
| Athelia rolfsii (телеоморфа) | |
| Стеблевой рак | Diaporthe phaseolorum |
| Diaporthe phaseolorum var. caulivora | |
| Phomopsis phaseoli (анаморфа) | |
| Стемфилиозная пятнистость | Stemphylium botryosum |
| Pleospora tarda (телеоморфа) | |
| Синдром внезапной гибели растений | Fusarium solani f.sp. glycines |
| Коринеспороз | Corynespora cassiicola |
| Нематоспорозная гниль | Nematospora coryli |
| Плесневение семян, кладоспориоз | Cladosporium herbarum, Cladosporium spp. |
| Корневая гниль, листовая пятнистость | Cylindrocarpon destructans |
| Аскохитоз | Ascochyta phaseolorum |
Вызываемые грибными болезнями сои потери урожая могут достигать 20–50% [Hartman et al., 2011; Баранов, Махонин, 2014; Delaney et al, 2018].
По данным отечественных авторов [Заостровных и др., 2018], в результате многолетнего (1972-2017 гг.) изучения состава возбудителей болезней сои в Западной Сибири и на Дальнем Востоке, в сибирско-дальневосточном регионе выявлено более 20 возбудителей грибных болезней сои. В условиях Дальневосточного региона выявлены 13 почвенных или корне-клубневых фитопатогенов сои: Fusarium oxysporum, F. semitectum, F. solani, F. avenaceum, F. gibbosum, F. moniliforme, Thielaviopsis basicola, Rhizoctonia solani, Corynespora cassiicola, Cylindrocarpon destructans, Pythium ultimum, Gliocladium roseum, Sclerotinia sclerotiorum, причём последние 7 видов являются возбудителями корневой гнили сложной этиологии. Наиболее распространёнными и вредоносными являются виды р. Fusarium, которые, в зависимости от фазы развития растений, составляют от 36,3% до 51,3% от всех возбудителей.
По данным тех же авторов, среди листостеблевых фитопатогенов сои в условиях Дальнего Востока распространены Septoria glycines, Peronospora manshurica, Cercospora sojina, Ascochyta phaseolorum, Colletotrichum truncatum, Phyllosticta sojaecola, Alternaria alternate, Cladosporium herbarum, Cercospora kikuchii.
В Западной Сибири среди возбудителей корне-клубневых инфекций, по данным указанных авторов, преобладают грибы р. Fusarium – F. oxysporum, F. solani, F. solani var. argillaceum, также отмечено наличие Sclerotinia sclerotiorum. Среди возбудителей листостеблевых инфекций обнаружены Septoria glycines, Peronospora manshurica, Ascochyta phaseolorum, Cercospora sojina.
Среди возбудителей семенной инфекции преобладают представители родов Fusarium, Alternaria, Penicillium, Pythium.
Таким образом, по данным [Заостровных и др., 2018], наиболее распространёнными и вредоносными возбудителями грибных заболеваний сои в регионах Дальнего Востока и Западной Сибири являются представители р. Fusarium. Аналогичные результаты для Западной Сибири получены и другими авторами [Горобей и др., 2011]. Отмечается, что распространённость фузариоза на проростках сои составляет 38–45 %, а на взрослых растениях – 100% при интенсивности развития заболевания 48,4–73,3 %.
По данным [Безмутко и др., 2019], наиболее вредоносными заболеваниями сои на Дальнем Востоке являются вызываемые грибами Fusarium spp., Cylindrocarpon destructans, Corynespora cassiicola, Thielaviopsis basicola корневые гнили, гибель растений от которых достигает 20-40%. При этом инфекция нередко носит комплексный характер. Наиболее вредоносными возбудителями, поражающими надземную часть растений сои на Дальнем Востоке, авторы называют Peronospora manshurica, Cercospora sojina и Septoria glycines. Комплекст этих возбудителей может вызывать потери урожая до 20%. Среди возбудителей семенной инфекции, по данным авторов, лидируют представители р. Fusarium, распространённость которых на семенах достигает 48%.
Литературные данные по распространённости и вредоносности возбудителей грибных болезней сои в Приенисейской Сибири отсутствуют
В качестве мер защиты сои от грибных болезней авторы рекомендуют химические фунгициды [Grichar, 2013; Delaney et al., 2018; Санкин, Безмутко, 2017; Безмутко, Кожевникова, 2018. 2019; Безмутко, Черепанова, 2020]. Однако отмечаемая многочисленными авторами растущая резистентность фитопатогенных грибов к фунгицидам [Ishii, 2006; Ocamb et al., 2007; Deising et al., 2008; Hollomon, 2015; Sevastos et al., 2017; Jackson-Ziems, 2017; Kukushkina et al., 2020] вкупе с растущей химической нагрузкой на агроценозы вызывают необходимость постепенной замены химических препаратов на биопрепараты, создаваемые на основе микроорганизмов-антагонистов, способных подавлять рост и развитие возбудителей болезней растений [Курилова, 2010; Баранов, Махонин, 2014; Семыкин и др., 2016; Штерншис и др., 2016; O’Brien, 2017; Жаркова, Манылова, 2018].
Несмотря на настоятельную потребность в биологических средствах защиты сои от грибных болезней, препараты, рассчитанные на применение на сое с учётом специфики региональных почвенно-климатических условий, на отечественном рынке отсутствуют. Имеется крайне ограничеснное число работ, посвящённых этой тематике. Так, в работе О.Г. Томиловой, А.С. Коробейникова и М.В. Штерншис [Томилова и др., 2009] на основе трёхлетних полевых опытов проанализировано влияние препаратов Фитолавин-300, Стрекар (оба препарата – на основе антибиотика фитобактериомицина), Бактофит (препарат, содержащий живую культуру антагонистической бактерии Bacillus subtilis и продуцируемые ею метаболиты), а также многоцелевого стимулятора Иммуноцитофита (на основе арахидоновой кислоты), на распространенность и развитие основных болезней сои, а также на урожайность данной культуры в условиях Западной Сибири. По данным авторов, несмотря на то, что при применении бактофита во все годы испытаний прослеживалась тенденция снижения развития и распространенности корневых гнилей сои, различия с контролем оказались статистически не достоверны, а прибавка урожая относительно контрольного варианта составила всего порядка 8%. Следует отметить, что Бактофит позиционируется производителем как препарат для защиты зерновых, плодовых и овощных культур, а также виноградников, но не для защиты сои и других зернобобовых.
В работе [Сырмолот, Кочева, 2019] проводилось сравнительное испытание биологического препарата Экстрасол (препарат на основе ризосферного штамма Bacillus subtilis, разработка Всероссийского НИИ сельскохозяйственной микробиологии, г. Краснодар, 1999 г.) и трёх опытных образцов биопрепаратов на основе штаммов ризосферных бактерий Bacillus subtilis (BZR 336g, BZR517) и Pseudomonas sp. (BZR 245-F), также созданных во Всероссийском НИИ биологической защиты растений (г. Краснодар) в качестве биологических средств защиты сои от болезней в условиях в условиях Приморского края. Хотя результаты в плане снижения распространённости основных болезней сои оказались достаточно обнадёживающими, прибавка урожая была относительно невелика, и, в зависимости от препарата и схемы его применения, варьировала от 7 до 28%. Тем не менее, авторы работы делают вполне справедливый, на наш взгляд, вывод о перспективности использования биопрепаратов для защиты сои от болезней.
По нашим данным, исследования по биологической защите сои от грибных болезней в Сибирском и Дальневосточном регионах фактически ограничиваются двумя цитируемыми выше работами.
2 Объекты и методы исследования
2.1 Особенности почвенно-климатических ресурсов зоны исследования
Красноярский край отличается значительной протяжённостью в меридиональном направлении, что обуславливает разнообразие почвенно-климатических условий территории. В границах региона выделяют три климатических пояса: арктический, субарктический и умеренный. Земледелие ведётся в пределах умеренного климатического пояса. Для территории края характерна также существенная разница климатических условий при движении с запада на восток.
Климат Красноярского края отличается степенью континентальности от Западной и Восточной Сибири. Средняя или Приенисейская Сибирь отличается годовым и суточным ходом температур, количеством осадков и их распределением в течение года, особенностями рельефа. Выделяют западные и восточные климатические области, граница которых проходит по долине реки Енисей. Кроме того, для земледельческой части территории края, наряду с поясной, характерна концентрическая зональность. Основные массивы распаханных земель на территории региона приурочены к островным лесостепям и степным районам. Для лесостепей характерен переход от степной зоны в центре или на юге через собственно открытую и закрытую лесостепь к подтаёжной зоне на границе. В предгорьях выделяют подтаёжную и таёжную зоны [Сергеев, 1971; Зубаилова, 2000].
Земледельческая часть региона характеризуется незначительной изменчивостью среднегодовой температуры. В северо-восточной части она варьирует в интервале -1,7–-1,9°С, в центральной и южной части от 0,3° (Красноярск) до 0,5°С (Минусинск). При этом характерны существенные колебания температуры по месяцам. Средняя амплитуда годового хода температур в лесостепной части края составляет 33–37°С, а в степной зоне достигают 38–40°С. Крайние значения амплитуды годового хода температуры увеличиваются до 62–75°С. Амплитуда годового хода температур, определённая по крайним значениям, определяется главным образом за счёт низких зимних значений. Минимальное значение зимних температур наблюдается в районах с пониженным рельефом. К таковым относятся территории Сухобузимской (Красноярская лесостепь) и Минусинской (южная степь) ГМС.
Циклонический характер погоды, наблюдающийся в летний период, сопровождается сильной турбулентностью, что способствует выравниванию температуры по месяцам. Температура самого тёплого месяца — июля колеблется в пределах 17–19°С. Максимальные температуры наблюдаются в Минусинской котловине. Особенностью климата является контрастность ночных и дневных температур. Главным образом это вызвано пониженными ночными температурами. Наибольшая разница суточного хода температур наблюдается в южный районах (Минусинская котловина). Низкие ночные температуры приводят к замедлению дыхания и других физиологических процессов растений, снижая, таким образом, расход органического вещества, синтезированного в дневное время. В результате увеличивается накопление белка и других запасных веществ.
Основным недостатком введённых в сельскохозяйственный оборот территорий края является низкое количество осадков. Преобладающий в Северном полушарии западный перенос воздушных масс, движущихся с Атлантического океана, приносит мало осадков в центр континента. При этом внутри края наблюдается сильная пестрота в распределении осадков, обусловленная особенностями рельефа. Максимальное их количество выпадает в горах и таёжной зоне, минимальное — в степи. Сезонная циркуляция атмосферы определяет годовой ход осадков. На зимний период приходится около 25% годовой суммы осадков. В совокупности с низкими температурами это приводит к значительному промерзанию почв (в районе действия Сухобузимской ГМС 1,7 м., Минусинской — 2,1 м.). В период вегетации также наблюдается крайне неравномерное распределение осадков. Весной и в начале лета часто повторяются засушливые условия. На весенний и осенний периоды приходится 13 и 10% осадков от годовой нормы. На долю июльских и августовских осадков приходится около 40% нормы. Осадки августа и сентября, на фоне пониженных среднесуточных температур, затягивают вегетацию полевых культур, приводят к снижению семенных качеств.
Необходимым условием эффективного фотосинтеза и, следовательно, урожайности, является количество приходящейся на подстилающую поверхность физиологически активной радиации (ФАР). Усреднённое значение ФАР составляет около 912 МДж/м 2 , что соответствует значениям на Европейской территории страны. Однако эффективность использования ФАР ниже, что вызвано дефицитом осадков и невысокими среднесуточными температурами.
К отрицательным метеоявлениям в период вегетации следует отнести сильные ветры, скорость которых превышает 15 м/с, а средняя продолжительность составляет 10–30 дней. Наибольшее их количество приходится на первую половину вегетации, что усиливает дефицит увлажнения.
Отличительной особенностью климата является малая теплообеспеченность летних месяц, короткая продолжительность отдельных периодов. Период с температурой выше 5°Сначинается в первой–второй декадах апреля и заканчивается в середине октября, таким образом, его продолжительность достигает 160 дней. Период активной вегетации (среднесуточные температуры выше 10°С) продолжается, в зависимости от района, 100–120 дней. Характерной особенностью резко континентального климата Приенисейской Сибири являются поздние весенние и ранние осенние заморозки. Период от последнего весеннего до первого осеннего заморозка на территории региона короче периода вегетации и часто соответствует по продолжительности времени активной вегетации. Разница в продолжительности безморозного периода в центральных и южных районах не превышает нескольких дней. Обычно последние весенние заморозки случаются в первой декаде июня, а первые осенние в начале сентября, реже — в последней декаде августа. Сила весенних заморозков не превышает -2°С, что не сказывается на состоянии сортов сои северного экотипа. Осенние заморозки, напротив, могут приводить к повреждению растений и формированию некондиционных по всхожести семян. Уклон материка в сторону Северного Ледовитого океана, а также меридиональное расположение горных хребтов способствует проникновению холодного арктического воздуха в земледельческие районы(Научно-прикладной справочник…, 1990).
Сумма активных температур, накапливающихся на земледельческой территории редко превышает 2000°С. В таёжный районах обеспеченность теплом составляет около 1650°С, тогда как в степи достигает 1800–2100°С. условия с дефицитом тепла случаются в 10–20% лет, т. е. 1–2 раза в десять лет. Комплексным показателем тепло- и влагообеспеченности выступает гидротермический коэффициент (ГТК). Величина этого показателя значительно меняется в зависимости от зоны края. Нормальное (ГТК 1,3) или избыточное увлажнение (ГТК≥1,6) часто наблюдается в таёжных и подтаёжных районах. Для островных лесостепей характерно неустойчивое увлажнение (ГТК 1,1–1,3). Засушливые условия с ГТК менее 1 случаются здесь два–три раза за десять лет. Для степной зоны характерным является проявление засухи с периодичностью раз в два года (Агроклиматические ресурсы…, 1974).
По классификации температурного режима почв (Димо, 1972) земледельческая часть Красноярского края относится к длительно сезоннопромерзающему типу. Длительность промерзания почв в лесостепях составляет, в среднем, 230 дней. Оттаивание почвы начинается в первой декаде апреля. Дата полного оттаивания почв колеблется в различные годы в широких пределах. В большинстве лет полное оттаивание заканчивается к концу июня, но в отдельные годы может затягиваться до середины июля. Среднегодовая температура поверхности почвы близка к среднегодовой температуре воздуха, в летнее время на поверхности почвы теплее.
Особенностью земледельческой территории Красноярскогокрая является пестрота почвенного покрова. Комплексность почв обусловливается следующими факторами: микрорельефом, микроклиматом, характером почвообразующих пород, жизнедеятельностью животных и гидротермическим режимом. Среди распаханных массивов в лесостепях преобладают чернозёмы (69,4%), причём выщелоченные занимают 39%, а обыкновенные 27% [Бугаков, Чупрова, 1995; Танделов, 1998; Крупкин, 2002]. Для введённых в сельскохозяйственный оборот почв лесостепей и степей региона характерна средняя и высокая гумусированность, повышенная обеспеченность фосфором и калием,низкое и среднее содержание цинка, марганца, кобальта, молибдена и высокое бора и меди (Волошин, 2006).Почвы с большей мощностью гумусового горизонта и более гумусированные приурочены к нижним частям склонов и к понижениям [Бугаков, 1971]. В целом характерными особенностями почв являются пространственная пестрота, карманистость и языковатость гумусового горизонта, его небольшая мощность.
2.2 Общая характеристика места исследования
Красноярская лесостепь, где были проведены исследования, расположена в Средней Сибири и входит в зону прохладного, с недостаточным увлажнением агроклиматического района с резко выраженным континентальным климатом. Это является причиной малого количества осадков. Среднегодовое количество осадков, выпадающих на территории Красноярской лесостепи, составляет около 380 мм. Результатом хорошо выраженной циркуляции атмосферы является неравномерное распределение осадков. Основное их количество (более 70%) приходится на теплый период, основная масса — на вторую половину лета. В это время они носят преимущественно ливневый характер, что удлиняет вегетацию растений и задерживает созревание. Среди распаханных массивов преобладают черноземы (64,9 %), причем выщелоченные занимают 39 %, а обыкновенные 27 % [Крупкин, 2002; Бугаков, Чупрова, 1995; Танделов,1998]. По содержанию гумуса, подвижных форм фосфора и калия, содержанию азота почвы лесостепи можно отнести к удовлетворительно и хорошо обеспеченным. Несмотря на это, высокую эффективность имеют минеральные удобрения, особенно стартовые дозы азота.
Полевые исследования по изучению эффективности инокуляции сои аборигенной культурой симбиотических азотфиксаторов выполнены на базе учебно-научного комплекса (УНПК) «Борский» (56°26′15″ с. ш. 92°54′11″ в. д.) ФГБОУ ВО Красноярский ГАУ. Опытно-производственная база расположена в Сухобузимском районе, Канско-Красноярской лесостепи. Преобладающей почвой в хозяйстве является комплекс чернозёмов выщелоченных мало-, среднемощных тяжелосуглинистого гранулометрического состава. Отбор почвенных образцов проведён за день до посева сои по методике агрохимической службы. Анализ выполнен в лаборатории агрохимии и агроэкологии Красноярского НИИСХ Обособленное подразделение ФИЦ КНЦ СО РАН по общепринятым методикам. Почвы опытного участка характеризуются высоким и средним содержанием гумуса (9,1-5,1%), нейтральной реакцией среды, высокой суммой обменных оснований (табл. 2.1).
Обеспеченность почвы подвижными формами фосфора средняя, калием – повышенная и высокая, нитратным азотом — средняя. Несмотря на это, высокую эффективность имеют минеральные удобрения, особенно стартовые дозы азота.
Таблица 2.1 – Агрохимическая характеристика почвы опытного поля УНПК «Борский»
Погодные условия за май–август 2020 г. имели значительные отличия от средних многолетних значений (рис. 2.1). Условия в мае сложились благоприятно: среднесуточная температура была выше нормы на 75%, а осадков выпало больше на 62,5 процентных пункта.
Похолодание в первой декаде июня (средняя температура 11,8°С) задержало появление всходов культуры и отрицательно сказалось на формировании клубеньков. Снижение нодуляции зернобобовыми культурами под влиянием низких температур изучено Senberga A., et. al. (2020).
Наблюдавшееся в дальнейшем превышение средних многолетних значений температуры и осадков было одной из причин интенсивного развития ассимиляционной поверхности образцов сои и способствовало эффективной азотфиксации. Во второй половине лета сложились засушливые условия (дефицит увлажнения за июль–август составил 16 процентных пунктов).
Усугублялась ситуация высокими среднесуточными температурами, максимальное превышение зафиксировано в августе (+ 3,2°С). Аномально тепло было в первой и второй декадах месяца, значения термометра превышали показатели в июле. Интенсивное развитие вегетативной массы сои и вызванное этим самозатенение растений привели к формированию низкой продуктивности культуры.
Рисунок 2.1 – Погодные условия в 2020 г. в месте проведения полевых исследований (ГМС «Сухобузимское»).
2.3 Методика лабораторных исследований
Для выделения бактерий использовали образцы почвы из-под посевов сои, отобранные на опытном поле в УНПК «Борский». Выделение проводили методом рассева на агаризованную питательную среду №1 ГРМ производства ФБУН ГНЦ ПМБ (панкреатический гидролизат рыбной муки – 15,0 г/л, панкреатический гидролизат казеина – 10,0 г/л, дрожжевой экстракт – 2,0 г/л, натрия хлорид – 3,5 г/л, глюкоза – 1,0 г/л, агар – 10,0 г/л), дополненной агаром до 20 г/л.
Для выделения фитопатогенных грибов использовали клубеньки, корни и надземные органы сои, выращенной в УНПК «Борский». Выделение грибов из корней и надземных органов проводили методом влажной камеры с последующим отсевом выросших грибов на искусственные питательные среды. Выделение грибов из семян и клубеньков проводили непосредственно на агаризованной питательной среде. Семена и клубеньки дезинфицировали с помощью 10% раствора гипохлорита, после чего многократно промывали стерильной водой и помещали на поверхность питательной среды, при этом клубеньки предварительно раздавливали с соблюдением асептики.
В качестве питательных сред для выделения грибов использовали Среду №2 ГРМ (Сабуро) производства ФБУН ГНЦ ПМБ (панкреатический гидролизат рыбной муки – 10,0 г/л, панкреатический гидролизат казеина – 10,0 г/л, дрожжевой экстракт – 2,0 г/л, натрия фосфат однозамещенный – 2,0 г/л, глюкоза – 40,0 г/л, агар – 20 г/л) и среду Чапека-Докса (сахароза – 20,0 г/л, нитрат натрия – 2,0 г/л, фосфат калия двузамещенный – 1,0 г/л, сульфат магния – 0,5 г/л, хлорид калия – 0,5 г/л, сульфат железа – 0,01 г/л, агар – 20 г/л). Для предотвращения бактериального роста в среду добавляли антибиотик ципрофлоксацин в количестве 5 мг/л.
Проверку антигрибной активности выделенных бактериальных штаммов проводили методом совместного культивирования (рис. 2.2). на среде №2 ГРМ (Сабуро), разведённой дистиллированной водой в 2 раза и дополненной агаром до 20 г/л. Предварительные исследования показали, что на подобной среде хорошо растут как бактериальные штаммы, так и все выделенные в ходе исследований фитопатогенные грибы.
Микроскопические исследования и микрофотосъёмку проводили с помощью микроскопа Микмед 6 вар. 3, оснащённого фазово-контрастным устройством и цифровой камерой DCM-130E. Измерения бактериальных клеток проводили по микрофотографиям с помощью программы ImageJ, для пересчёта пикселей в микрометры использовали объект-микрометр проходящего света ОМП ГОСТ 7513-55 производства ОАО “ЛОМО”.
Лабораторную эффективность наиболее активных штаммов-антагонистов в подавлении развития фузариоза и других грибных болезней в сравнении с химическим протравителем проверяли методом рулонных культур на сое сорта Заряница (оригинаторы – ФГБНУ Омский аграрный научный центр, ФГБОУ ВО Красноярский ГАУ; регион допуска – Восточно-Сибирский). В эксперименте использовали семена, полученные в в УНПК «Борский» и характеризующиеся высоким (свыше 60%) уровнем естественной заражённости фузариозом.

Рисунок 2.2 – Проверка антибиотической активности бактериальных штаммов в отношении фитопатогенных грибов методом совместного культивирования
Схема эксперимента включала следующие варианты: контроль (семена без обработки); бактеризация штаммом RSA-1; бактеризация штаммом RSA-13; обработка химическим протравителем; искусственное заражение возбудителями фузариоза; искусственное заражение возбудителями фузариоза + бактеризация штаммом RSA-1; искусственное заражение возбудителями фузариоза + бактеризация штаммом RSA-13; искусственное заражение возбудителями фузариоза + обработка химическим протравителем. В каждом варианте было 4 повторности, по 50 семян в повторности. В качестве химического протравителя использовали препарат “Оплот” (действующие вещества: дифеноконазол – 90 г/л, тебуконазол – 45 г/л) производства АО Фирма “Август”, обработку семян проводили в соответствии с инструкцией производителя.
Бактеризацию проводили водными суспензиями штаммов-антагонистов с титром 10 8 клеток на мл из расчёта 1 мл суспензии на 100 г семян, что соответствует стандартному расходу 10 л на тонну при обработке семян в полевых условиях. Искусственное заражение проводили суспензией конидий, полученной смывом с 10-суточных колоний четырёх морфологически различающихся изолятов Fusarium sp., выделенных из поражённых фузариозом растений сои, титр 10 6 конидий на мл. Учёт распространённости фузариоза проводили в соответствии с Межгосударственным стандартом ГОСТ 12044-93 “Семена сельскохозяйственных культур. Методы определения зараженности болезнями”. Распространённость фузариоза вычисляли как выраженное в процентах отношение растений с признаками заболевания к общему числу растений. Кроме распространённости фузариоза, учитывали длину надземной части проростков сои.
Идентификацию грибов проводили по культурально-морфологическим признакам.
Идентификацию наиболее эффективных бактериальных штаммов проводили методом секвенирования гена 16S рРНК в Национальном биоресурсном центре – Всероссийская коллекция промышленных микроорганизмов (БРЦ ВКПМ), г. Москва.
Отработку методов получения пилотных партий биопрепаратов проводили на аграризованных и жидких питательных средах. В качестве основного показателя учитывали количество образованных штаммами спор на единицу площади (в случае культивирования на агаризованных средах) или на единицу объёма (в случае культивирования на жидких питательных средах). Для определения численности спор, производимых исследуемыми штаммами при выращивании на агаризованной среде, культуру выращивали газоном на чашке Петри до завершения цикла развития. После этого микробный материал смывали, суспендировали в заданном объёме воды и подсчитывали число спор методом прямого счёта с использованием фазово-контрастной микроскопии, после чего пересчитывали число спор на единицу площади питательной среды. При выращивании на жидкой питательной среде штаммы инкубировали методом глубинного культивирования до завершения цикла развития культуры, после чего также проводили подсчёт образовавшихся спор методом прямого счёта с последующим пересчётом на единицу объёма культуры. Доверительные интервалы вычисляли с помощью программы GraphPad’s QuickCalcs согласно [Patil, Kulkarni, 2012].
2.4 Методика полевых исследований
Для полевых испытаний использовали два сорта сои, районированных в Сибири – Заряница и Эос. Ниже представлено описание этих сортов.
Сорт Заряница: скороспелый сорт, созданный в Красноярском государственном аграрном университете и Омском аграрном научном центре. Включён в Госреестр по Восточно-Сибирскому региону. Рекомендован для возделывания в Красноярском крае. Срок созревания ранний. Растение детерминантного типа развития, низкое – средней высоты. Гипокотиль с антоциановой окраской. Опушение главного стебля рыжевато-коричневое. Боковой листочек сложного листа заострённо-яйцевидный. Цветок фиолетовый. Семена жёлтые, рубчик тёмно-коричневый. Время начала цветения раннее. Вегетационный период – 91 день. Масса 1000 семян – 158 г. Содержание белка в семенах – 38,5%, жира – 18,9%. Высота растений – 65 см. Высота прикрепления нижнего боба – 11 см. Продолжительность вегетативного периода – 102 дня. Сорт отличается высоким адаптивным потенциалом и имеет максимальную урожайность до 4,4 т/га. Содержание масла в зерне сорта Заряница составляет 19,1%, белка 36%. Характеризуется высокой устойчивость к фузариозу, пероноспорозу, средней восприимчивостью к бактериозу и церкоспорозу. Средняя урожайность семян в регионе – 20 ц/га. Максимальная урожайность семян – 37 ц/га, получена на Краснотуранском ГСУ Красноярского края в 2016 году.
Сорт Эос: скороспелый сорт сои Восточно-Сибирского экотипа, созданный в Красноярском государственном аграрном университете. Высота растений в зависимости от условий выращивания 52–101 см. Форма растений кустовая, тип роста детерминантный, форма роста полупрямостоячая. Масса 1000 семян 154–164 г. Продолжительность вегетационного периода 103 дня. Средняя урожайность 2,16 т/га, на 0,23 т/га больше стандарта. По выходу белка и жира на 17% и 11% превышает показатели стандартного сорта СибНИИК 315. Коммерческая ценность: скороспелость, повышенная продуктивность, адаптивная способность, относительно высокое расположение нижних бобов (16 см), дружное созревание, выровненные семена [Абдураимов, 2019]
Полевые опыты по исследованию влияния бактериальных штаммов-антагонистов на развитие грибных болезней, нодуляцию и урожайность сои выполнены в зернопаропропашном севообороте чистый пар–картофель–соя–яровая пшеница. Основная обработка — осеннее плоскорезное рыхление на глубину 15–17 см. Весной выполнено ранневесеннее боронование и предпосевная культивация на глубину 5–6 см КПС-4. Посев сои выполнен 22 мая селекционной сеялкой ССФК-7, рядовым способом с учётом всхожести, чистоты и массы тысячи семян. Коэффициент высева оптимальный для зоны исследования [Чураков, 2009] и составил 0,8 млн. всхожих семян на 1 га. После посева выполнено прикатывание кольчато-шпоровыми катками. Для стимулирования нодуляции семена сои обрабатывали аборигенным штаммом ризобактерий, зарекомендовавшим себя в качестве эффективного микросимбионта сортов Эос и Заряница в полевых опытах, проводившихся в 2019 г. Титр инокулята составляла 1 × 10 7 клеток/мл. В опытных вариантах семена дополнительно обрабатывали споровыми суспензиями штаммов-антагонистов с титром 1 × 10 7 клеток/мл из расчёта 10 мл суспензии на 1 кг семян, контролем служили семена без обработки.
Повторность опытов 4-кратная, площадь делянки 6,7м 2 , размещение делянок – рандомизированное. Полевые опыты, наблюдения за развитием растений выполнены в соответствии с общепринятыми рекомендациями для полевых экспериментов с культурой [Коллекция генетических…, 2010; Синеговская с соавт, 2016]. В лабораторных условиях проводился анализ структуры урожая. При анализе учитывали количество продуктивных узлов, бобов и семян с растения, измеряли высоту растений и прикрепление первых бобов. Уборку делянок проводили напрямую комбайном «Terrion» в период полной спелости культуры. Семена очищались на ситах с диаметром ячейки 4×20 мм, взвешивались с точностью до 1 г, урожайность приводилась к стандартной влажности 14 %.
2.5 Математическая обработка данных
Статистическую обработку проводили с помощью пакета StatSoft STATISTICA 6.0 и пакета анализа MS Excel 2007. Для определения статистической значимости различий между вариантами экспериментов по индивидуальным показателям использовали однофакторный (ANOVA) и многофакторный (Factorial ANOVA) дисперсионный анализ с последующей оценкой значимости различий между индивидуальными средними с помощью рангового критерия Дункана. В качестве факторов выступали штамм-антагонист и генотип сои. Для определения статистической значимости различий между вариантами по комплексу показателей и для оценки вклада отдельных показателей в различия между вариантами использовали дискриминантный анализ. Для выявления связей между показателями использовали корреляционный и регрессионный анализ. Для сравнения вариантов с контролем по качественным признакам (распространённость заболеваний) использовали точный F-тест для таблиц 2х2.
3 Таксономический состав и распространённость возбудителей грибных болезней сои в регионе
В ходе исследований из семян, клубеньков, корней и листьев сои были выделены фитопатогенные и факультативно-патогенные грибы, представленные в таблице 3.1.
Таблица 3.1 – Фитопатогенные и факультативно-патогенные грибы, выделенные в ходе исследований
| Представители | Источник | Частота встречаемости |
| Rhizopus spp. | Семена, поражённые плесенью | Умеренная |
| Aspergillus spp. | Семена, поражённые плесенью | Умеренная |
| Penicillium spp. | Семена, поражённые плесенью | Умеренная |
| Cladosporium spp. | Семена, стебли, листья | Умеренная |
| Fusarium spp. | Корни, клубеньки, стебли, семена, листья | Очень высокая |
| Alternaria alternana, Alternaria spp. | Листья | Редко |
| Acremonium strictum | Корни, прикорневые части стебля | Умеренная |
| Rhizoctonia solani | Корни, прикорневые части стебля | Умеренная |
| Pythium spp. | Корни, прикорневые части стебля | Умеренная |
Наиболее распространёнными возбудителями грибных болезней сои в регионе оказались грибы р. Fusarium. Распространённость данного заболевания на корнях и в клубеньках в середине вегетационного периода достигала 100% (рис. 3.1-3.3), а интенсивность развития болезни на растениях в середине вегетации – 70-75%.
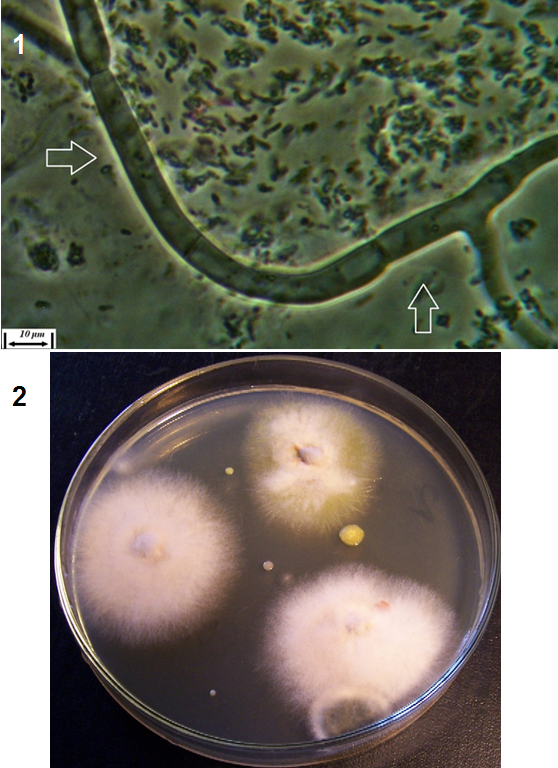
Рисунок 3.1 – Фузариозная инфекция клубеньков сои: 1 – мицелий Fusarium sp. в гомогенате клубеньков, 2 – выделение грибов р. Fusarium из клубеньков
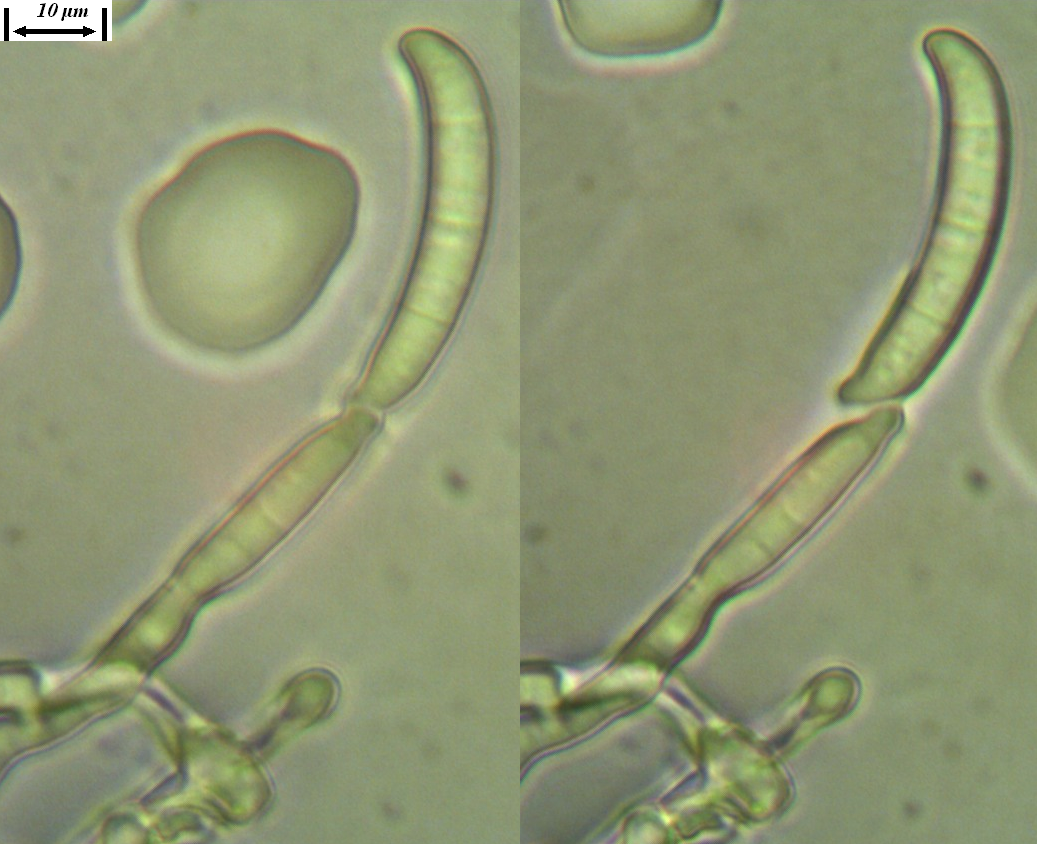
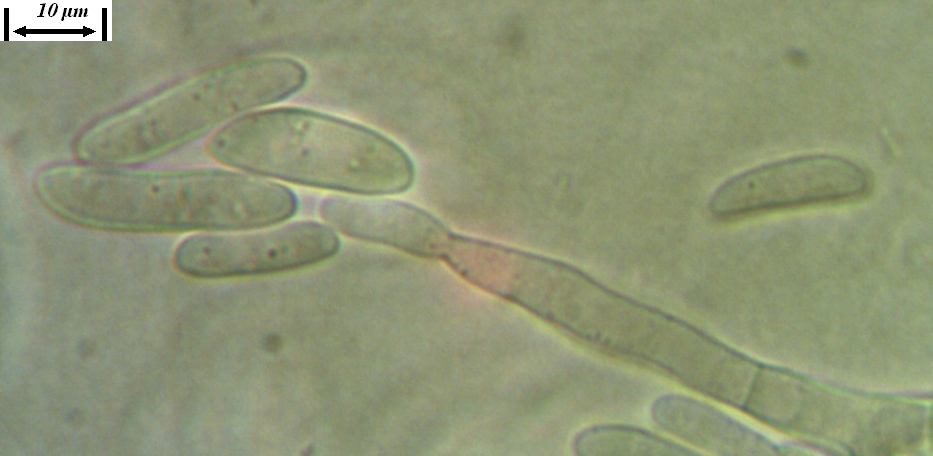
Рисунок 3.2 – Характер образования микро- и макроконидий изолятов р. Fusarium, выделенных из клубеньков сои.
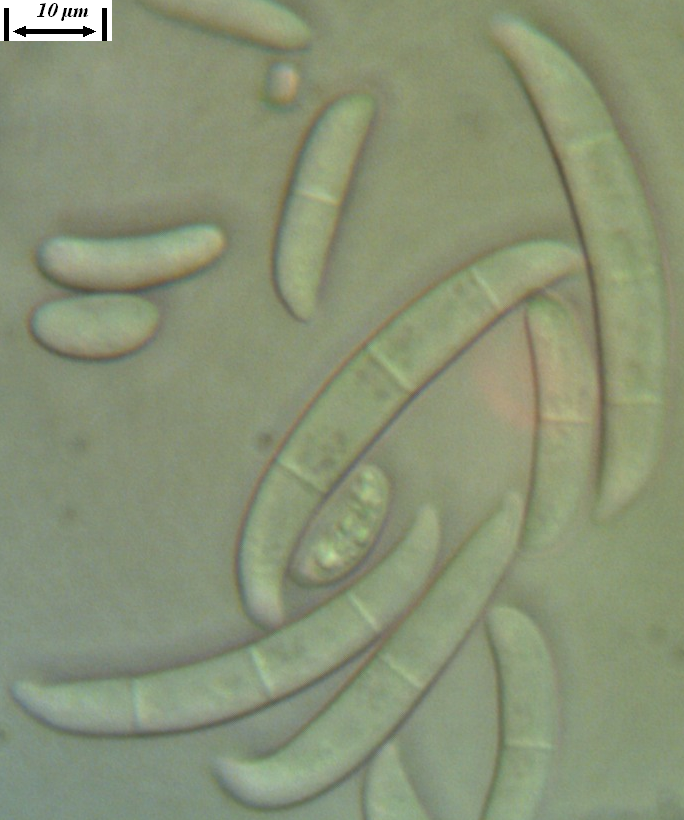
Рисунок 3.3 – Микро- и макроконидии грибов р. Fusarium, выделенных из корней сои.
Наряду с грибами р. Fusarium, из корней и прикорневых частей стебля выделялись Acremonium strictum, Rhizoctonia solani, Pythium spp.
Распространённость грибов Fusarium spp. в семенах была несколько ниже, чем на подземных частях растений, и составляла порядка 60%, или свыше 90% от всех возбудителей болезней сои, выделяемых из семян (рис. 3.4).
Рисунок 3.4 – Доля грибов р. Fusarium среди возбудителей семенной инфекции сои.
Исключение составляли семена, поражённые плесневыми грибами. На таких семенах встречался комплекс грибов, характерных для заболевания, известного как “плесневение семян сои” – представители родов Rhizopus, Aspergillus, Penicillium и Cladosporium. Представители р. Cladosporium также выделялись из стеблей и листьев, чаще всего – в составе комплексной инфекции.
Среди возбудителей листовой пятнистости свыше 90% составляли грибы р. Fusarium, в остальных случаях встречались представители родов Alternaria и Cladosporium.
Таким образом, преобладающими возбудителями грибных болезней сои в регионе оказались грибы р. Fusarium. Это в значительной степени совпадает с результатами, полученными для Дальнего Востока и Западной Сибири [Горобей и др., 2011; Заостровных и др., 2018; Безмутко и др., 2019] , однако в наших исследованиях преобладание грибов р. Fusarium над другими возбудителями грибных болезней сои оказалось существенно более ярко выраженным.
Ниже представлены микрофотографии выделенных нами возбудителей болезней сои, не относящихся к р. Fusarium.
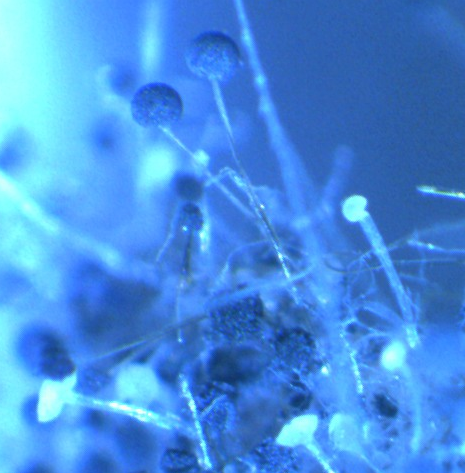
Рисунок 3.5 – Rhizopus sp. на поражённом плесенью семени сои

Рисунок 3.6 – Aspergillus niger (1), Aspergillus sp. (2) и Penicillium sp. (3), выделенные из поражённых плесенью семян сои.

Рисунок 3.7 – Cladosporium herbarum, выделенный из листьев сои.
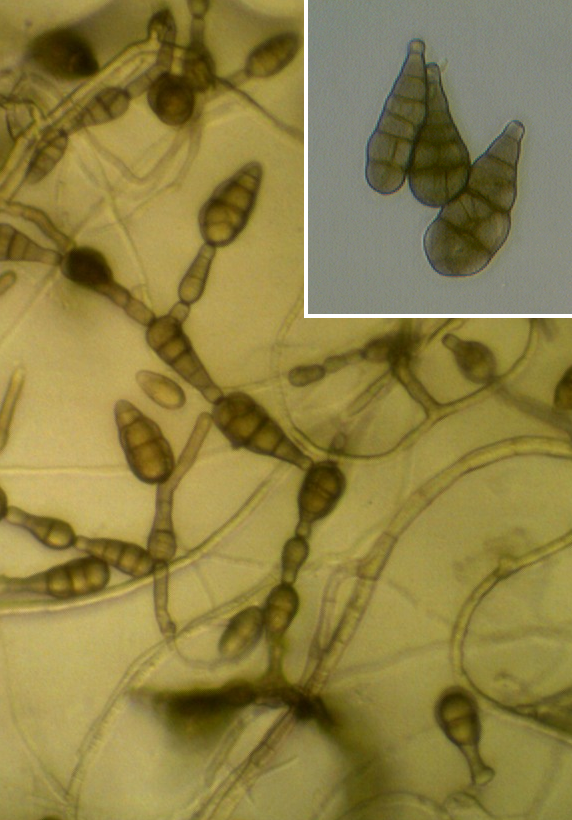
Рисунок 3.8 – Alternaria sp., выделенная из листьев сои.
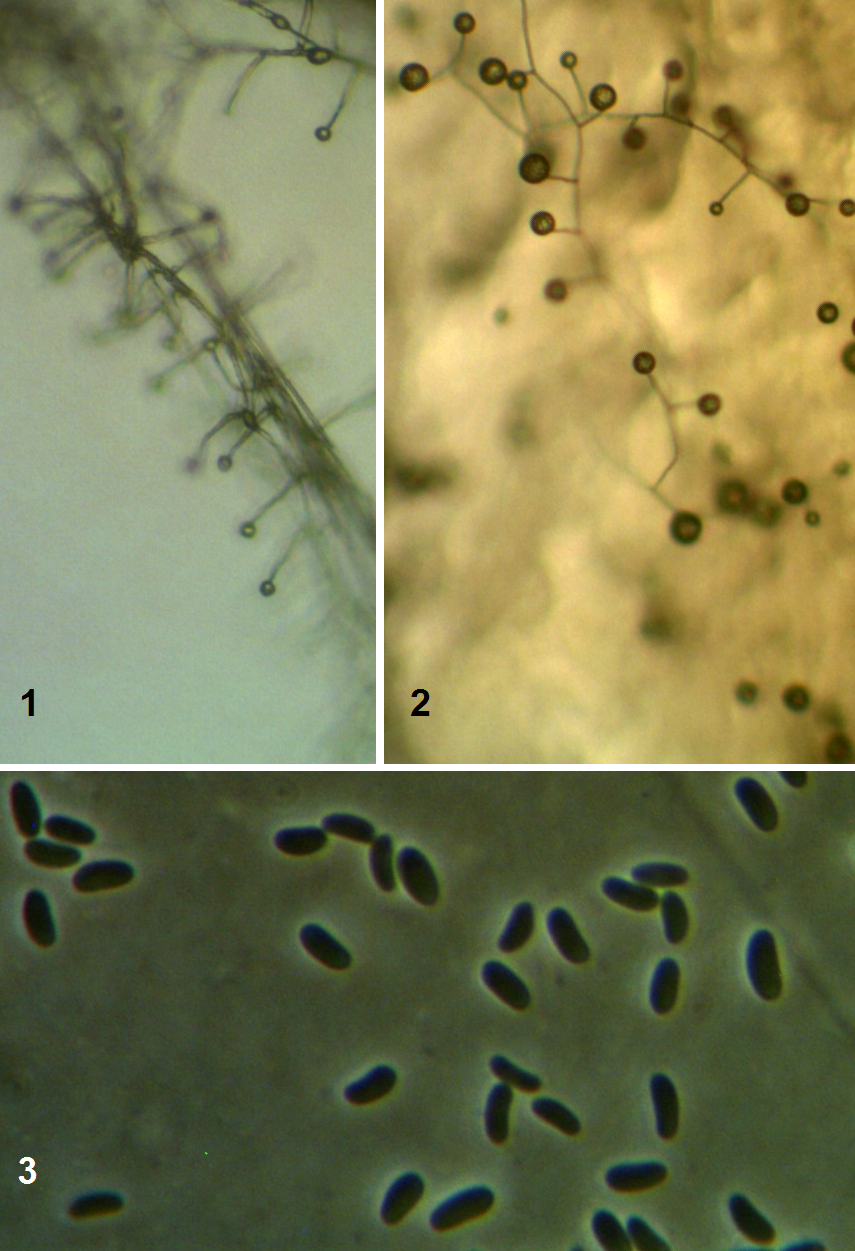
Рисунок 3.9 – Acremonium strictum, выделенный из корней сои: 1 – рост на корнях во влажной камере, 2 – рост на питательной среде, 3 – конидии на большом увеличении (объектив 100х, фазовый контраст).
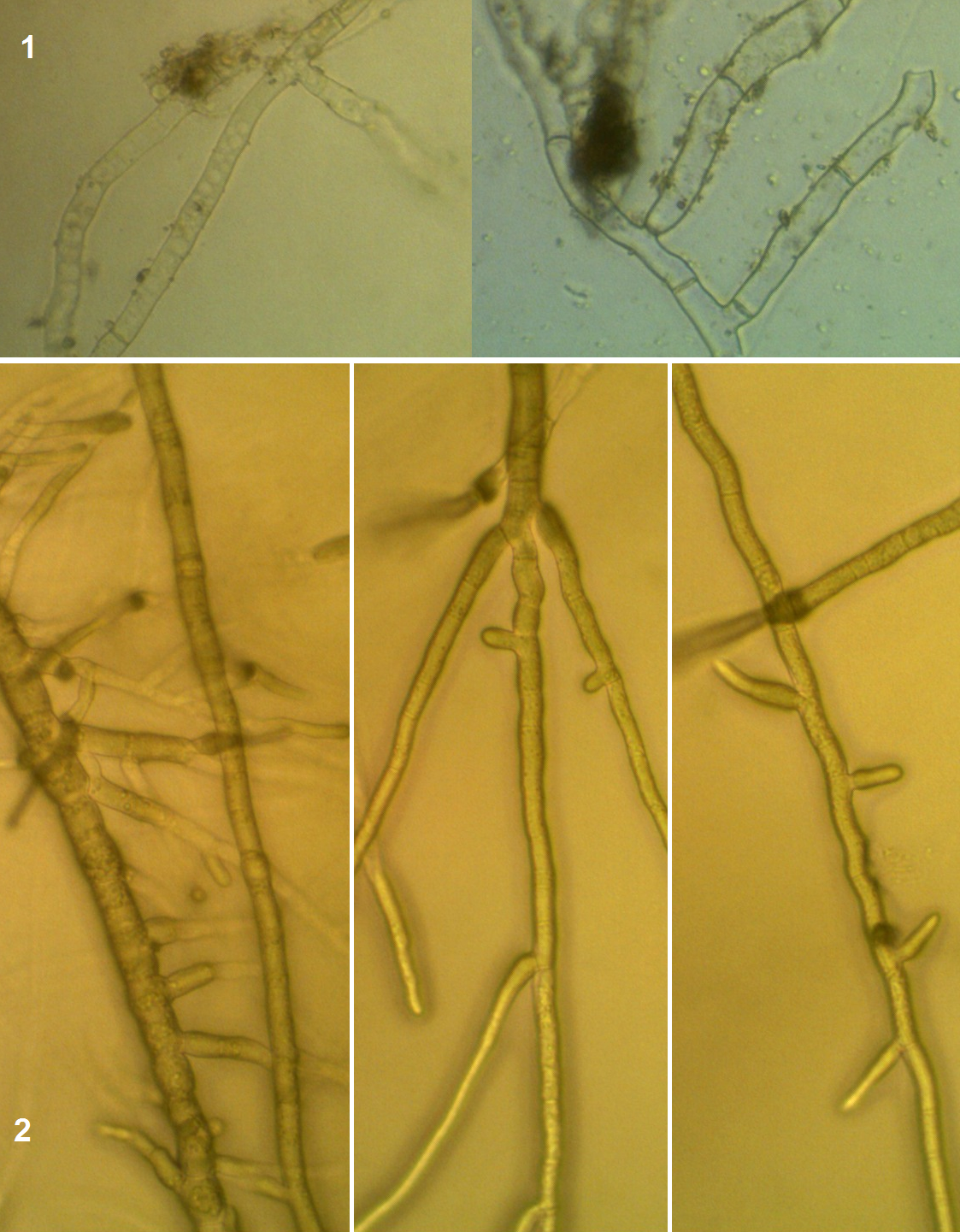
Рисунок 3.10 – Rhizoctonia solani, выделенный из корней сои: 1 – рост мицелия во влажной камере, 2 – рост на питательной среде.
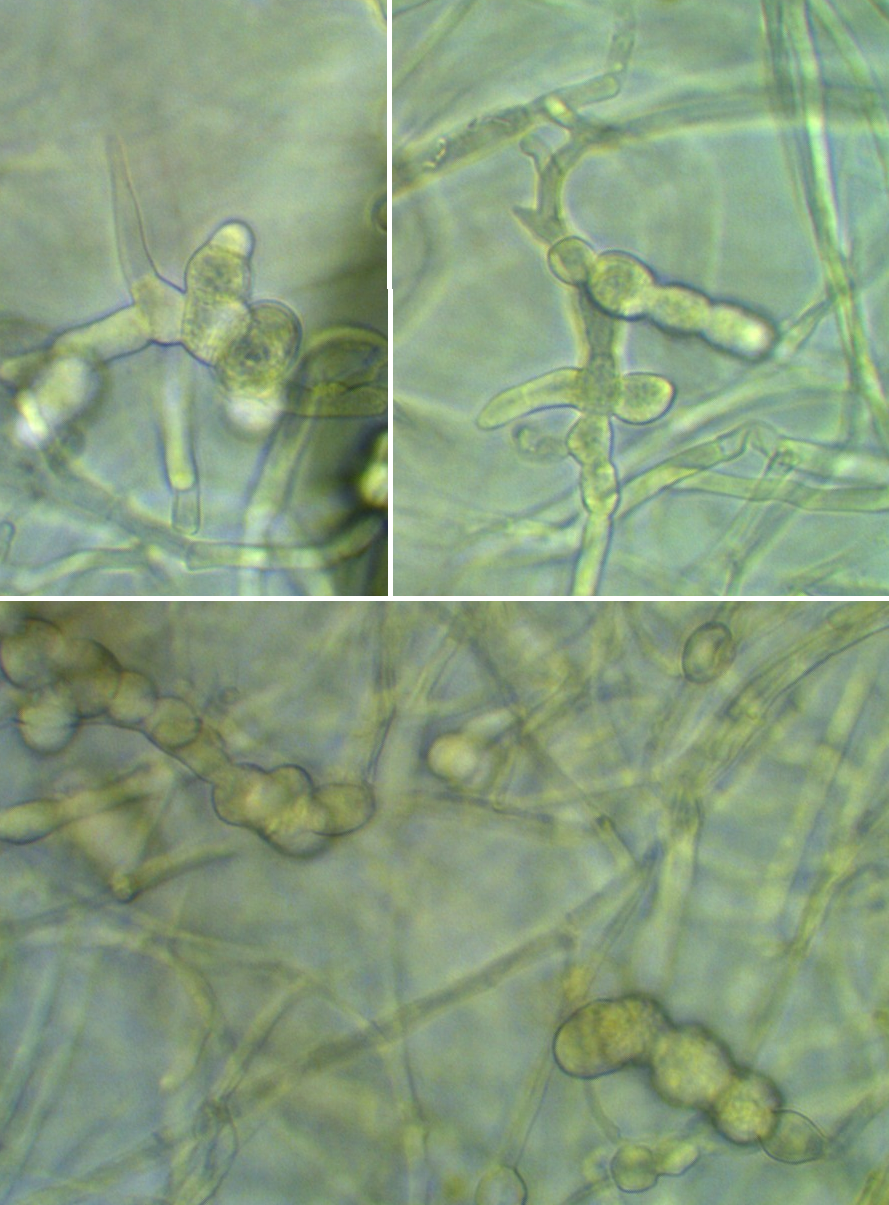
Рисунок 3.11 – Pythium sp., выделенный из корней сои.
Заключение по главе 3
Комплекс возбудителей грибных болезней сои в регионе представлен главным образом Fusarium spp., Cladosporium spp., Alternaria spp., Acremonium strictum, Rhizoctonia solani, Pythium spp. На всех органах сои, а также на семенах, существенно преобладают виды р. Fusarium spp. Их распространённость на корнях и клубеньках достигает 100%, на семенах – 60% (что составляет более 90% от всех возбудителей болезней сои, выделяемых из семян). Представители этого рода являются также основными возбудителями листовой пятнистости. В середине вегетационного периода интенсивность развития фузариоза достигает 70-75%.
Среди возбудителей плесневения семян выявлены представители родов Rhizopus, Aspergillus, Penicillium.
Составленная в ходе выполнения исследований коллекция актуальных для региона возбудителей грибных болезней сои была использована для тестирования штаммов-антагонистов.
4 Выделение штаммов-антагонистов для борьбы с грибными болезнями сои в Сибири
В ходе исследований из почв сельскохозяйственного назначения и из ризосферы сои было выделено 23 бактериальных штамма, обладающих широким спектром антибиотической активности в отношении фитопатогенных грибов. Среди выделенных штаммов 7 были идентифицированы как представители актинобактерий, предварительно идентифицированными как р. Streptomyces, 15 штаммов были представлены спорообразующими грамположительными палочками сем. Bacillaceae, предварительно идентифицированными как р. Bacillus, 1 штамм был представлен аспорогенными палочками. Все штаммы являются аборигенными, то есть эволюционно адаптированы к почвенно-климатическим условиям региона.
Известно, что именно представители родов Streptomyces и Bacillus наиболее часто используются для биологического контроля фитопатогенных грибов, в первую очередь – благодаря способности формировать устойчивые к высокой температуре и высыханию споры, что является ценным свойством с точки зрения приготовления и хранения биологических препаратов, а также благодаря широкому спектру их антибиотической активности и способности эффективно колонизовать ризосферу растений [Emmert, Handelsman, 1999; Nega, 2014; Fira et al., 2018; Newitt et al., 2019; Anusha et al., 2019; Colombo et al., 2019, 2020].
Несмотря на относительно медленный рост и малый размер колоний штаммов актинобактерий в сравнении с представителями сем. Bacillaceae, практически во всех случаях измеряемая по зоне отсутствия роста антигрибная активность актинобактерий была существенно выше, чем активность бактерий. Кроме этого, спектр антигрибной активности актинобактерий в большинстве случаев был выше, чем спектр антигрибной активности представителей сем. Bacillaceae (рис. 4.1, 4.2).
Аналогичная картина наблюдалась и в отношении других фитопатогенных грибов, в том числе – принадлежащих к разным таксонам.
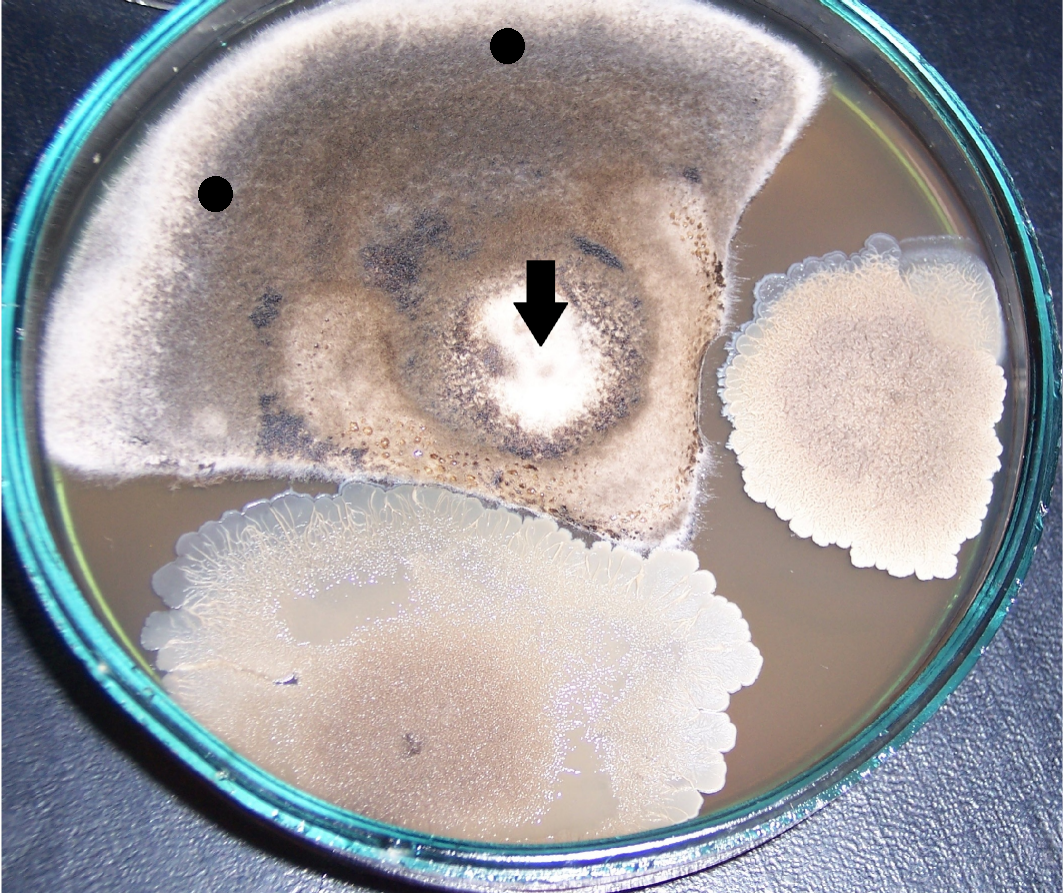
Рисунок 4.1 – Подавление роста Rhizoctonia solani в присутствии штаммов RSA-16(1) и RSA-16(2) (сем. Bacillaceae, предварительно идентифицированы как представители р. Bacillus). Стрелкой показано место точечного посева R. solani. Чёрными точками показаны места посева штаммов RSA-12 и RSA-12 (сем. Bacillaceae, предварительно идентифицированы как представители р. Bacillus), эффективных против изолятов Fusarium spp, однако не проявивших антибиотической активности в отношении R. solani.
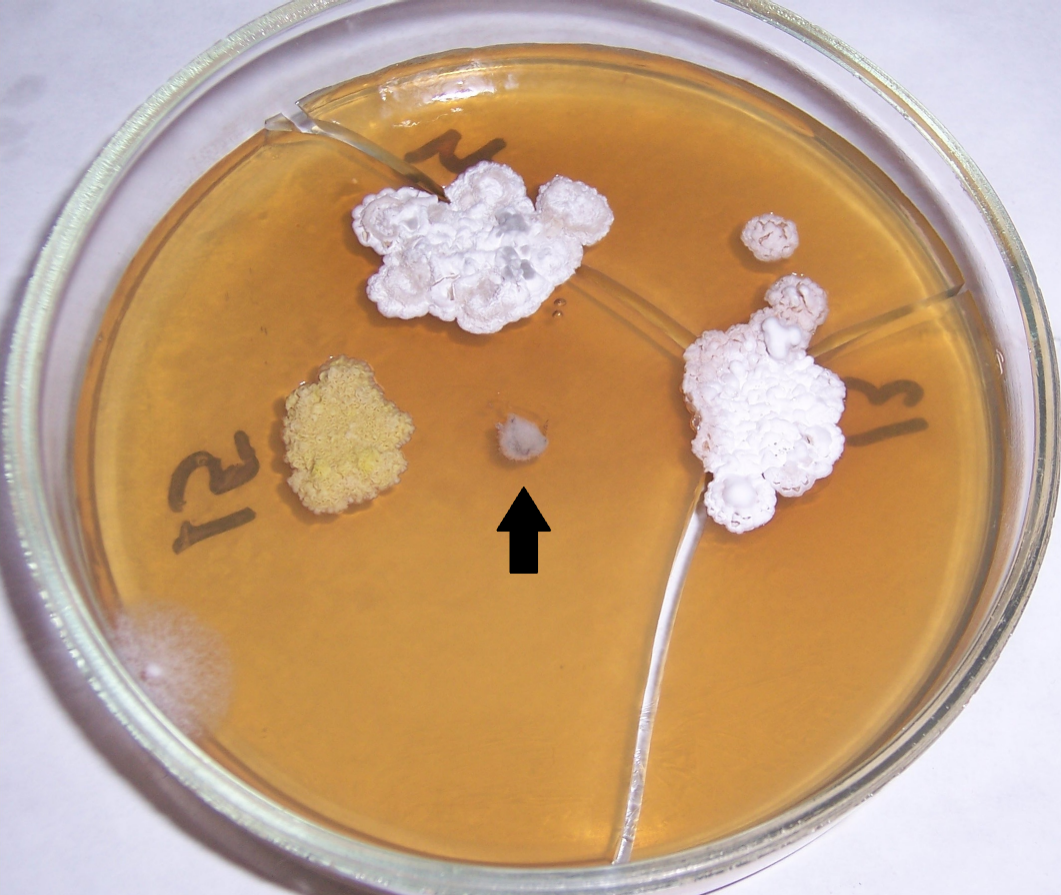
Рисунок 4.2 – Подавление роста Rhizoctonia solani в присутствии штаммов RSA-16(1) и RSA-16(2) (сем. Bacillaceae, предварительно идентифицированы как представители р. Bacillus). Стрелкой показано место точечного посева R. solani.
Если в присутствии штаммов сем. Bacillaceae подавление фитопатогенных грибов ограничивалось наличием зоны отсутствия роста тест-культуры, а также аномальным развитием мицелия, то в присутствии актинобактерий в целом ряде случаев тест-культура вообще не развивалась, а кондидии были неспособны к формированию проростковых трубок (рис. 4.3, 4.4, на примере Alternaria alternata).
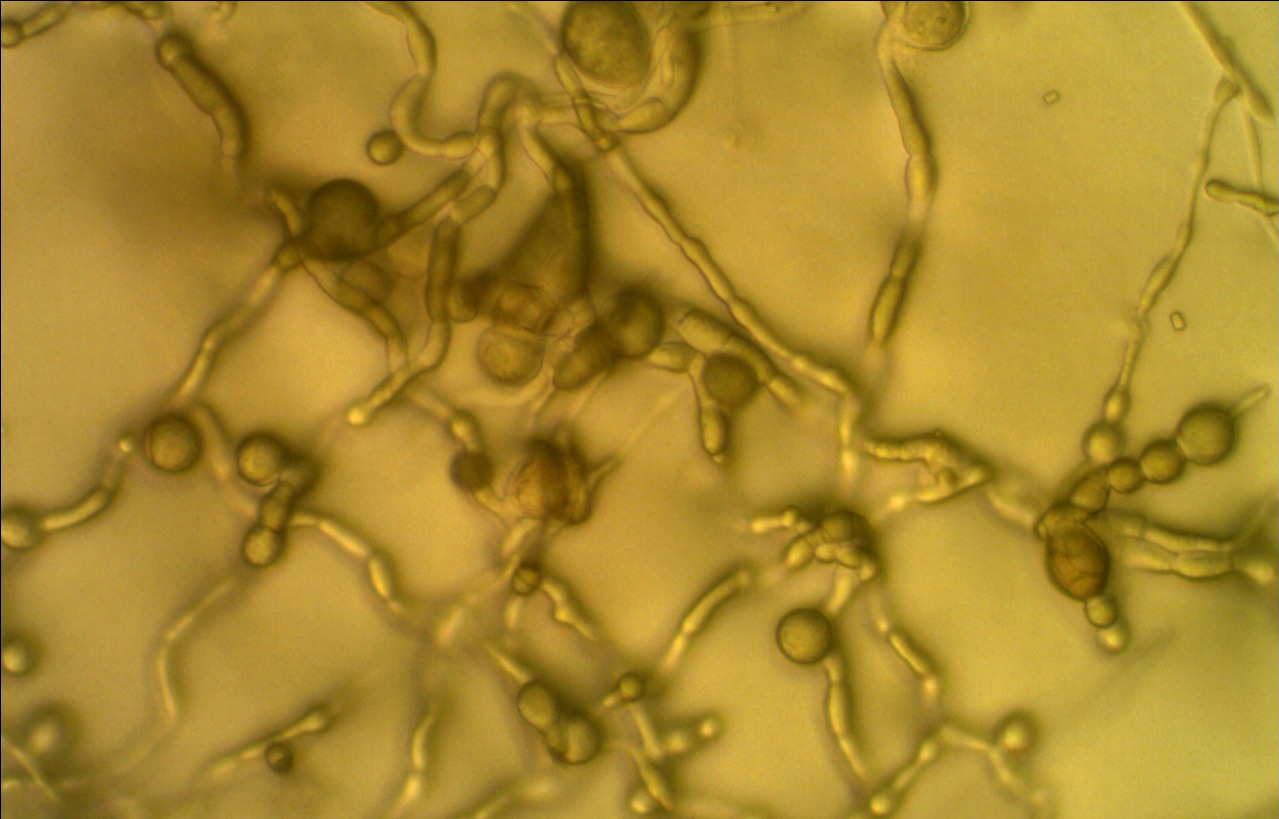
Рисунок 4.3 – Аномальный мицелий Alternaria alternata в присутствии штамма RSA-1 (р. Bacillus).


Рисунок 4.4 – Отсутствие прорастания конидий Alternaria alternata в присутствии штамма RSA-13 (р. Streptomyces). Вместо формирования проростковых гиф конидии набухают и лопаются, формирования мицелия не происходит.
На основании изучения спектра антигрибной активности для лабораторных испытаний были выбраны два штамма: RSA-1 (р. Bacillus) и RSA-13 (р. Streptomyces). Эти штаммы продемонстрировали способность эффективно подавлять развитие фитопатогенных и факультативно фитопатогенных грибов, относящихся к трём отделам (Zygomycota, Ascomycota, Basidiomycota), а также развитие грибоподобных протистов (отдел Oomycota) (табл. 4.1).
Таблица 4.1 – Спектр антигрибной активности штаммов RSA-1 и RSA-13
| Отдел | Представители | Вызываемые заболевания |
| Zygomycota | Rhizopus spp. | Плесневение семян |
| Ascomycota | Aspergillus spp. | Плесневение семян |
| Penicillium spp. | Плесневение семян | |
| Cladosporium spp. | Плесневение семян, кладоспориоз | |
| Fusarium spp. | Фузариоз | |
| Alternaria alternana, Alternaria spp. | Альтернариоз | |
| Bipolaris sorokiniana* | Гельминтоспориоз | |
| Acremonium strictum | Стеблевая гниль | |
| Basidiomycota | Rhizoctonia solani | Ризоктониоз |
| Oomycota | Pythium spp. | Питиозная корневая гниль |
*Выделен из яровой пшеницы в качестве дополнительного тест-объекта
При этом в случае фитопатогенных грибов р.р. Cladosporium, Fusarium, Alternaria, Bipolaris, Rhizoctonia, Pythium оба штамма продемонстрировали способность подавлять не только рост изолятов, выделенных из растений сои, но и рост изолятов, выделенных из других сельскохозяйственных культур (яровая пшеница, картофель).
Как и в случае остальных штаммов, уровень антигрибной активности представителя р. Streptomyces (штамм RSA-13) оказался выше, чем представителя р. Bacillus (штамм RSA-1) (рис. 4.5, см. также рис. 4.4).
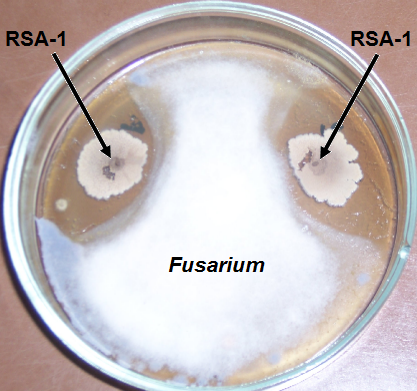

Рисунок 4.5 – Подавление изолята Fusarium штаммами RSA-1 и RSA-13
Ниже представлены примеры антигрибной активности штаммов RSA-1 и RSA-13.
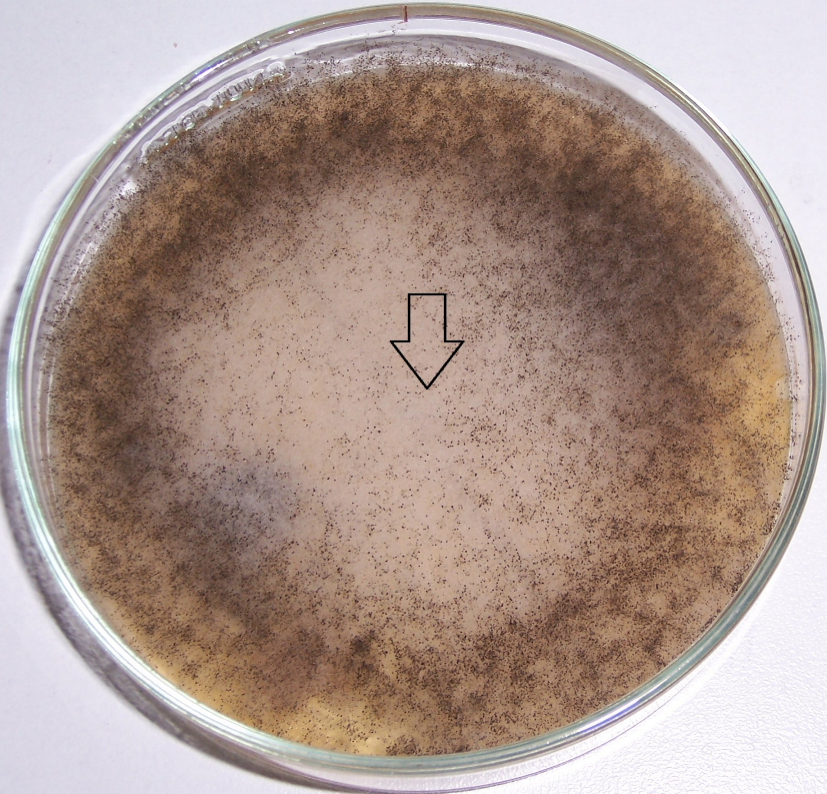
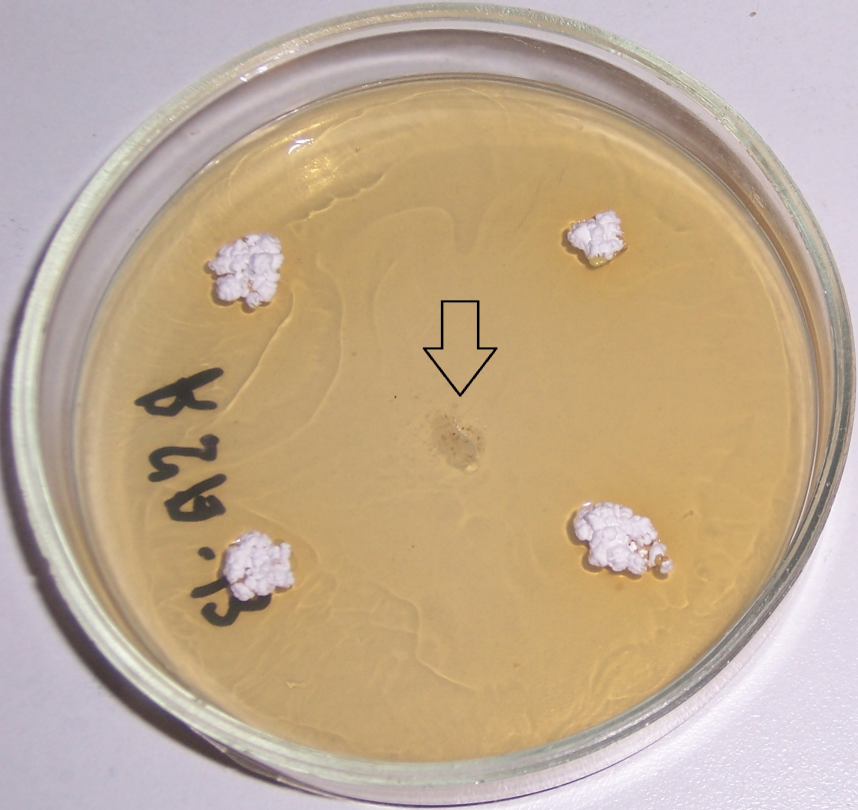
Рисунок 4.6 – Подавление роста изолята Rhizopus sp. штаммом RSA-13. Стрелкой показано место точечного посева тест-культуры.
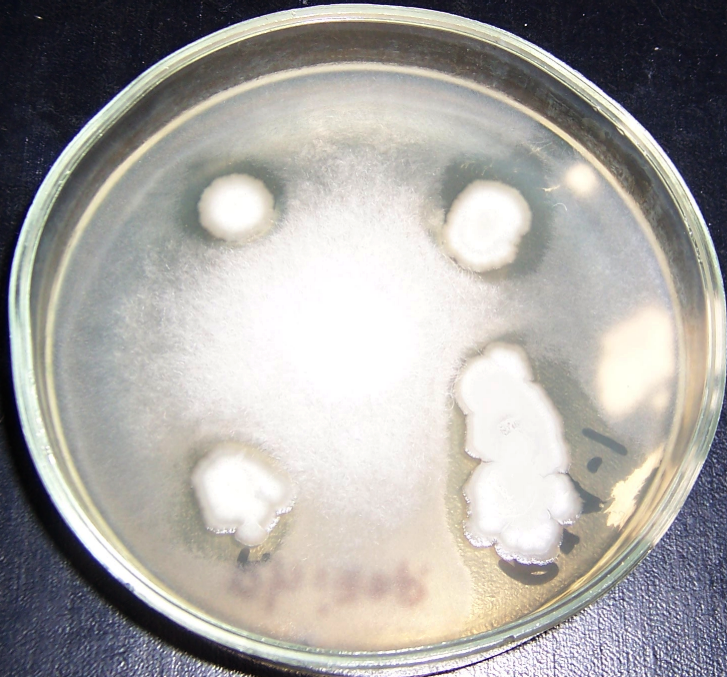
Рисунок 4.7 – Подавление роста изолята Rhizopus sp. штаммом RSA-1.
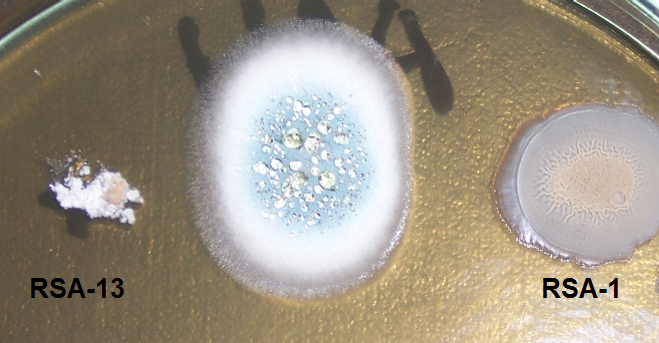
В отношении таких фитопатогенов, как Acremonium strictum, Bipolaris sorokiniana, Cladosporium spp., а также сапротрофов Penicillium spp. антибиотическая активность штаммов примерно одинакова (рис. 4.8-4.10).
Рисунок 4.8 – Подавление роста грибов р. Penicillium штаммами RSA-1 и RSA-13.
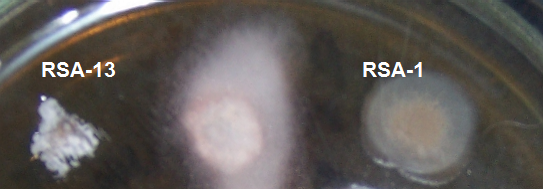
Рисунок 4.9 – Подавление роста Acremonium strictum штаммами RSA-1 и RSA-13.
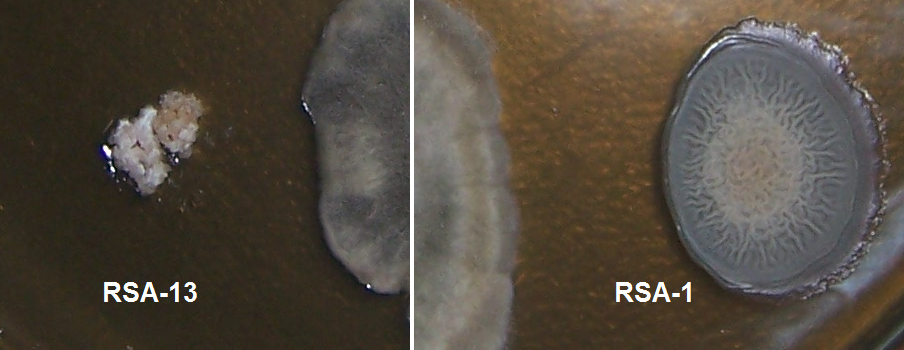
Рисунок 4.9 – Подавление роста Bipolaris sorokiniana штаммами RSA-1 и RSA-13.
В отношении сапротрофных грибов р. Aspergillus антибиотическая активность штамма RSA-1 оказалась выше, чем активность штамма RSA-13 (рис. 4.10).
В отношении грибоподобных протистов штамм RSA-13, в отличии от штамма RSA-1, практически не проявил активности (рис. 4.11).
Указанные различия в интенсивности антагонистического воздействия штаммов RSA-1 и RSA-13 на представителей разных таксономических групп свидетельствует о том, что спектр выделяемых данными штаммами антибиотических веществ различается.

Рисунок 4.10 – Подавление роста грибов р. Aspergillus на примере A. niger штаммами RSA-1 и RSA-13.
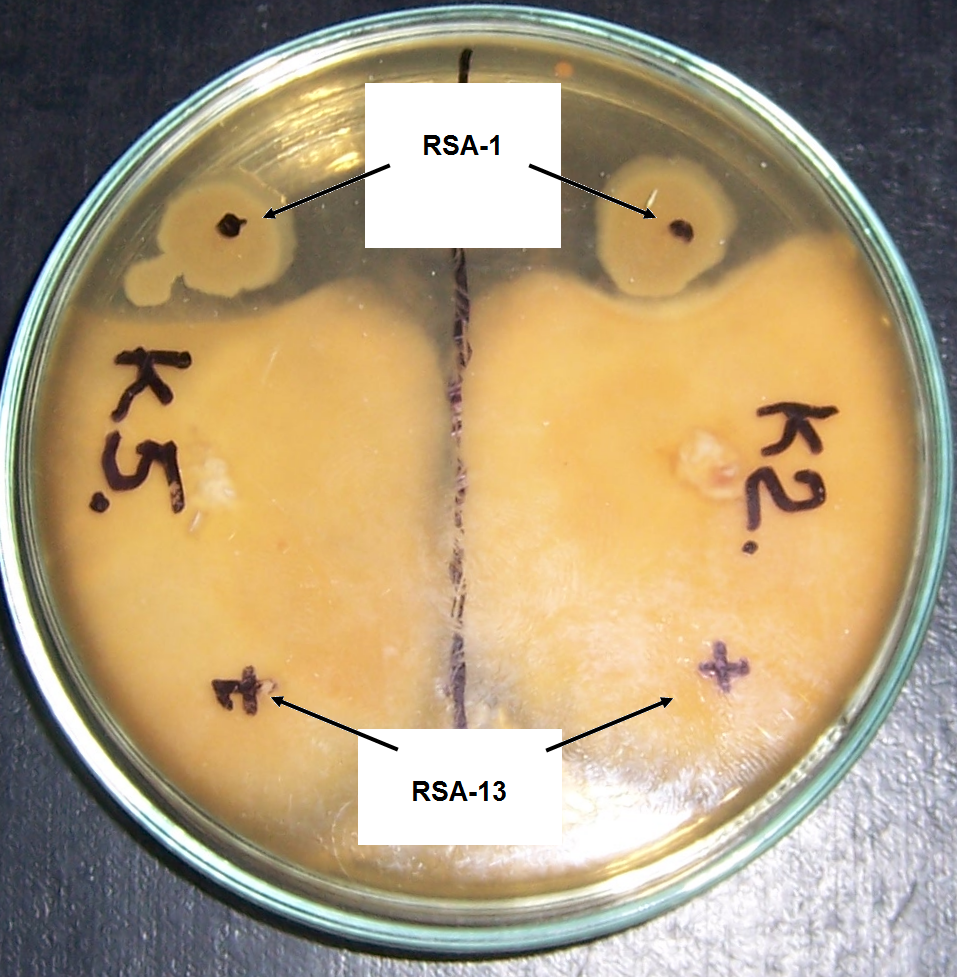
Рисунок 4.11 – Влияние штаммов RSA-1 и RSA-13 на рост грибоподобных протистов р. Pythium.
Ниже представлено микробиологическое описание и результаты молекулярно-генетической идентификации штаммов RSA-1 и RSA-13.
Штамм RSA-1 формирует плоские колонии бежевого цвета с морщинистой поверхностью и ризоидным краем (рис. 4.12, 4.13). При старении культуры колония приобретает более тёмный цвет, а в среду выделяется коричневый пигмент.
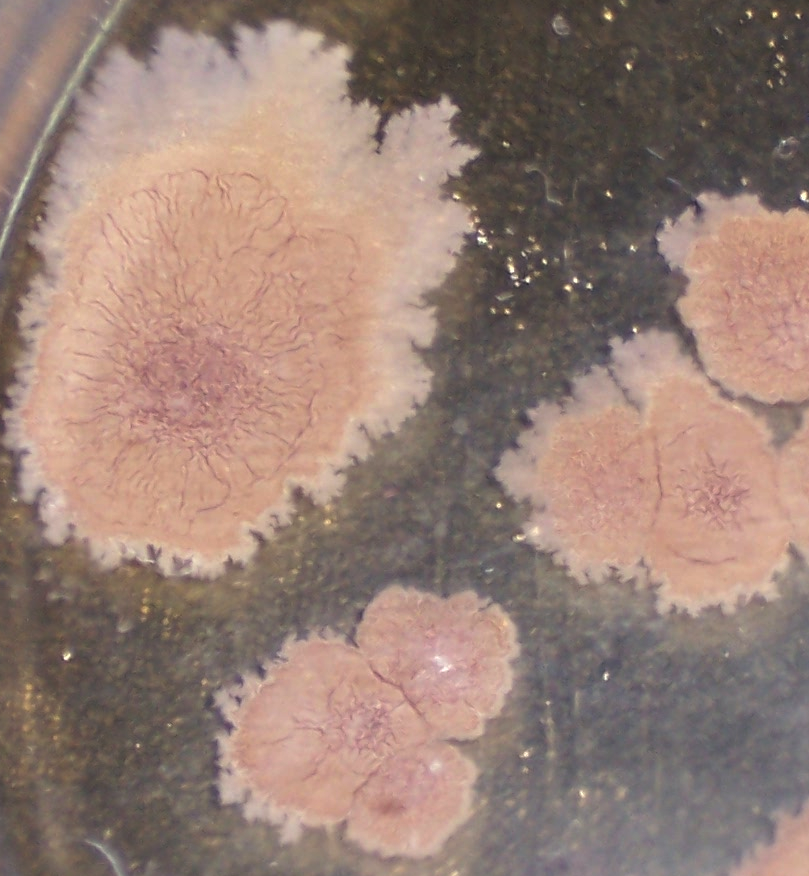
Рисунок 4.12 – Внешний вид колоний штамма RSA-1
Более подробно характер роста штамма RSA-1 на различных питательных средах обсуждается в главе 6. Микроколония штамма на ранних стадиях роста представлена на рис. 4.14.
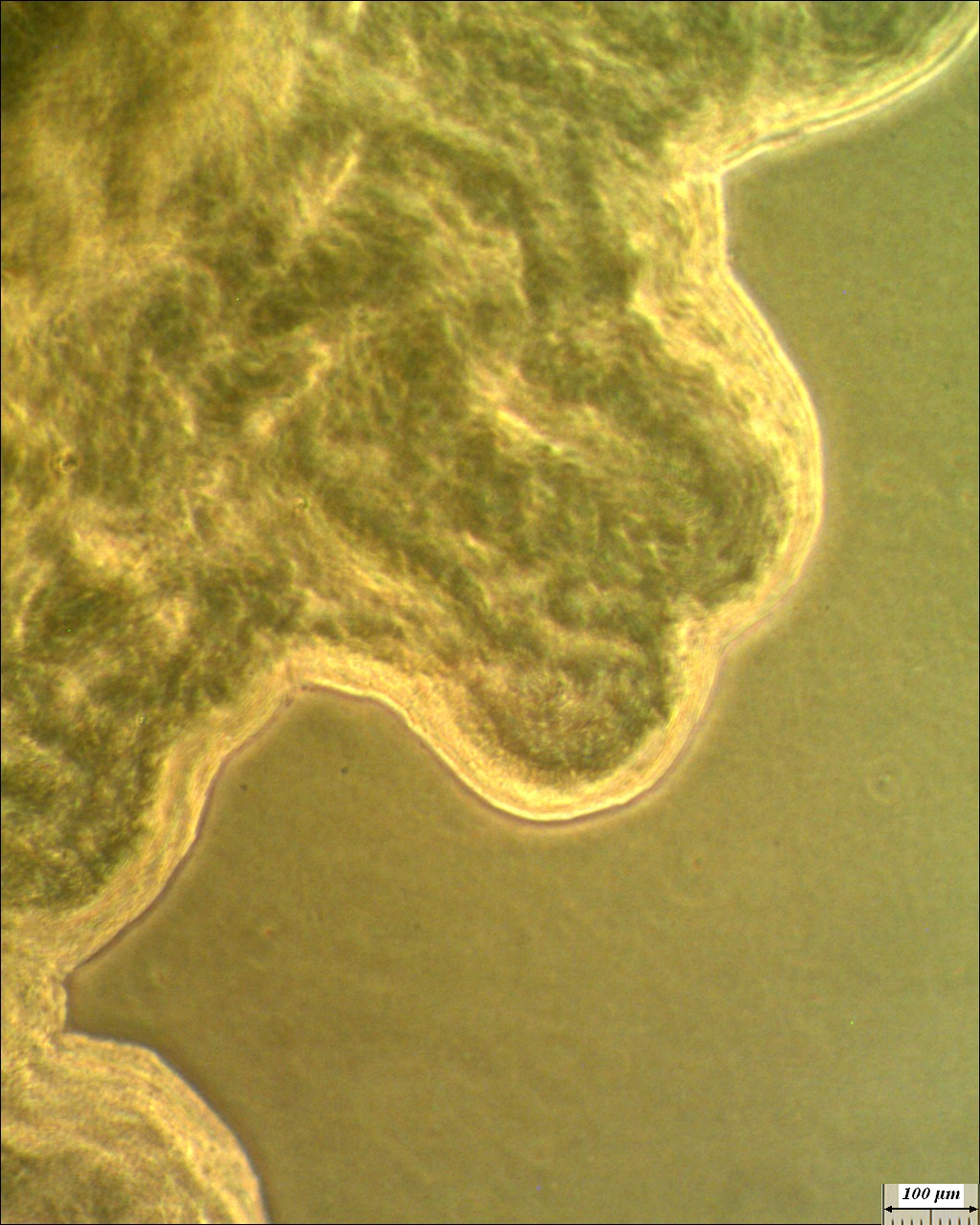
Рисунок 4.13 – Край колонии штамма RSA-1. Длина линейки – 100 микрометров.
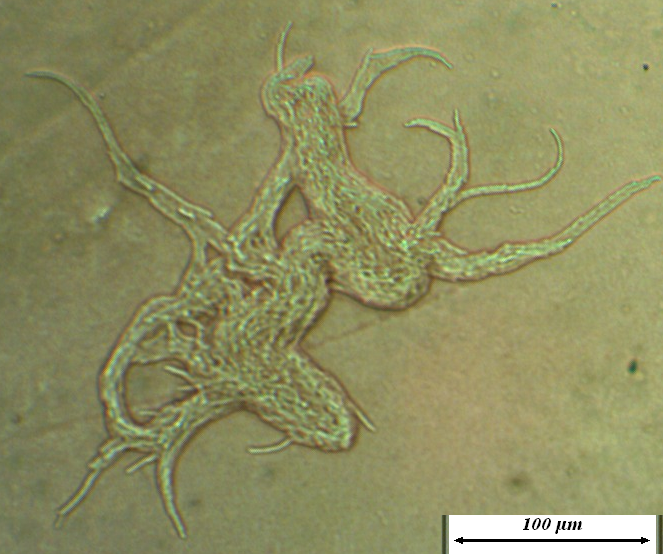
Рисунок 4.14 – Микроколонии штамма RSA-1 на ранних стадиях роста (17-часовая культура при 22-24ºС). Длина линейки – 100 микрометров.
Штамм RSA-1 представлен грамположительными аэробными подвижными спорообразующими палочками. Эндоспора – овальная, 1,5-2,4 х 0,7-1,3 мкм, расположение в клетке – центральное или субтерминальное. При образовании споры клетка не раздувается (рис. 4.15).
Прорастание эндоспоры споры – латеральное (рис. 4.16). Молодые клетки – до 24 мкм длиной (рис. 4.17), клетки в зрелой культуре – 4,2-9,6 х 1,1-1,3 мкм (рис. 4.18). Образование на ранней стадии роста удлинённых клеток, содержащих несколько нуклеоидов, характерно для представителей р. Bacillus.
Температурный оптимум роста лежит в районе 29-30ºС. При температуре 22-24ºС прорастание спор начинается через 6-8 часов, прорастание 100% спор завершается через 12 часов.
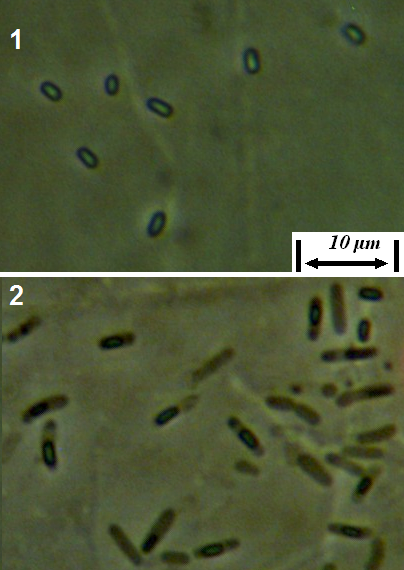
Рисунок 4.15 – Штамм RSA-1: 1 – эндоспоры, 2 – клетки с эндоспорами; длина линейки – 10 микрометров. Масляная иммерсия, фазовый контраст.
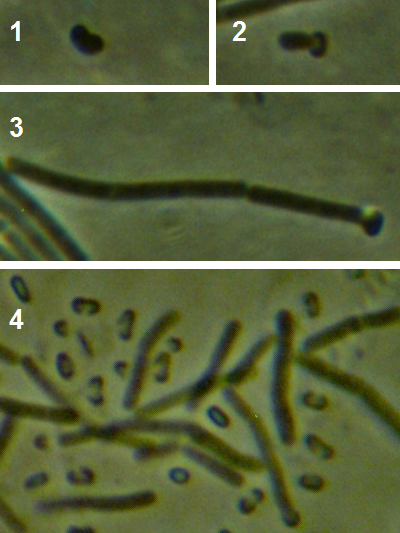
Рисунок 4.16 – Характер прорастания эндоспор у штамма RSA-1: 1 – набухшая спора; 2 – начало прорастания; 3 – проросшая спора; 4 – молодые вегетативные клетки в окружении пустых споровых оболочек. Масляная иммерсия, фазовый контраст.
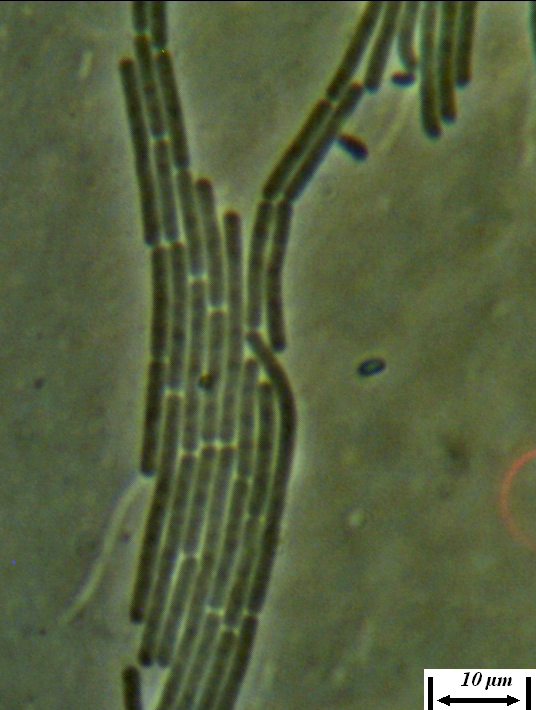
Рисунок 4.17 – Удлинённые клетки в молодой культуре штамма RSA-1 (17- часовая культура при 24-26ºС); длина линейки – 10 микрометров. Масляная иммерсия, фазовый контраст.
Рисунок 4.18 – Клетки в зрелой культуре штамма RSA-1 (начало формирования эндоспор); длина линейки – 10 микрометров. Масляная иммерсия, фазовый контраст.
При секвенировании вариабельных участков гена 16S рРНК для исследуемого штамма RSA-1 получена следующая собранная нуклеотидная последовательность:
По результатам проведенного анализа секвенсов вариабельных участков генов, кодирующих 16S рРНК, а также ПЦР анализа с использованием видоспецифических праймеров тестируемый штамм наиболее близок к виду Bacillus atrophaeus (уровень сходства более 99%, Приложение 1).
Вид Bacillus atrophaeus Nakamura 1989 относится к царству Bacteria, типу Firmicutes, классу Bacilli, порядку Bacillales, семейству Bacillaceae, роду Bacillus. Ранее данные бактерии относили к Bacillus subtilis var. niger, однако в 1989 году были выделены в отдельный вид [Nakamura, 1989]. Благодаря способности к выработке чёрного пигмента B. atrophaeus широко используется в качестве биоиндикатора при отработке методов дезинфекции, в том числе – в качестве суррогатного организма при отработке методов защиты от возбудителя сибирской язвы Bacillus anthracis [Fritze, Pukall, 2001; Greenberg et al., 2010].
В последние годы (2018-2020) была продемонстрирована возможность использования B. atrophaeus в качестве агента для биологической защиты растений от болезней, однако нам удалось обнаружить лишь три публикации на эту тему [Ma et al., 2018; Rajaofera et al., 2019, 2020]. Относительно спектра антибиотических веществ, продуцируемых B. atrophaeus, литературные данные не обнаружены.
Штамм RSA-13 представлен грамположительными аэробными ветвящимися актинобактериями. На агаризованных питательных средах формирует врастающие в агар выпуклые колонии белого цвета с ворсистой поверхностью и лопастевидным краем. Максимальный диаметр колоний – 10-12 мм.
На поверхности колоний нередко наблюдаются капли экссудата (рис. 4.19).
Ворсистость поверхности обусловлена хорошо развитым воздушным мицелием, формирующимся на поверхности колонии (рис. 4.20).
Микроскопические исследования показали, что вегетативная форма представлена мицелием, характерным для актинобактерий. Мицелий хорошо развитый, ветвящийся, субстратный и воздушны, толщина гиф варьирует от 0,8 до 1,7 мкм. Споры – овальные, 1,4-1,8 х 0,9-1,2 мкм, формируются в закрученных спорангиях на воздушном мицелии (рис. 4.21 – 4.23). Подвижные стадии не выявлены.
Оптимальная температура роста – в районе 29-30ºС. При температуре 22-24ºС прорастание спор происходит в интервале 24-48 часов, формирование воздушных спорангиев начинается через 60-72 часов после посева спор на питательную среду.

Рисунок 4.19 – Внешний вид колоний штамма RSA-13. На поверхности колоний хорошо видны капли экссудата.
Рисунок 4.20 – Воздушный мицелий на колонии штамма RSA-13. Длина линейки – 100 микрометров.
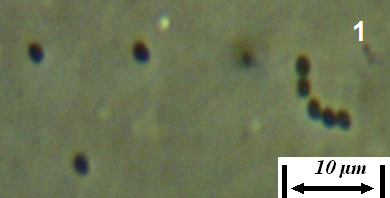
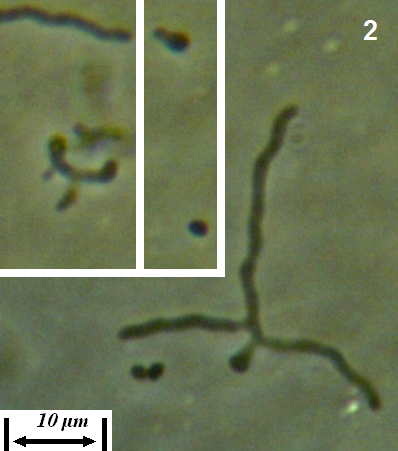
Рисунок 4.21 – Споры (1) и прорастание спор (2) штамма RSA-13. Длина линейки – 10 микрометров. Масляная иммерсия, фазовый контраст.
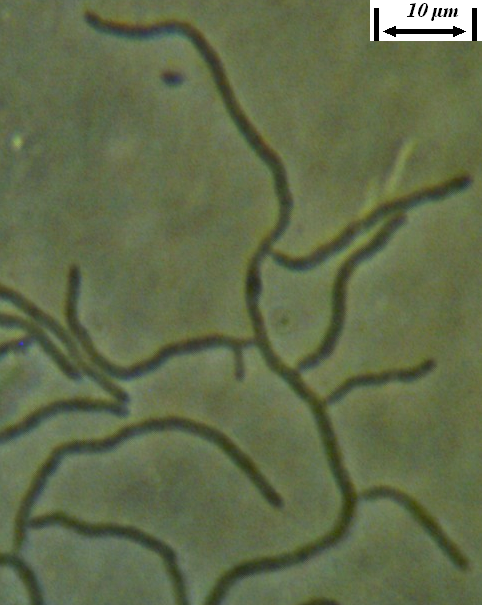
Рисунок 4.22 – Субстратный мицелий штамма RSA-13. Длина линейки – 10 микрометров. Масляная иммерсия, фазовый контраст.
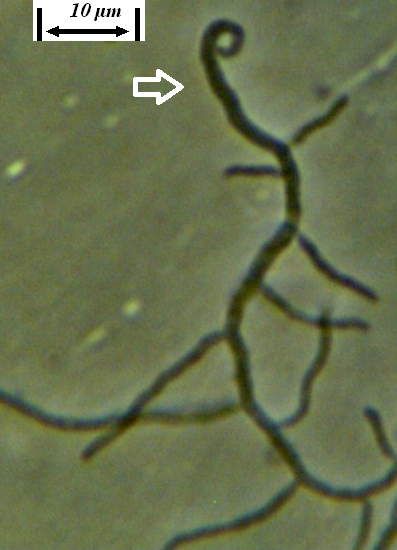
Рисунок 4.23 – Формирующийся спорангий штамма RSA-13. Длина линейки – 10 микрометров. Масляная иммерсия, фазовый контраст.
При секвенировании вариабельных участков гена гена 16S рРНК получена следующая собранная нуклеотидная последовательность для исследуемого штамма RSA-13:
По результатам анализа секвенсов вариабельных участков генов, кодирующих 16S рРНК, тестируемый штамм наиболее близок к виду Streptomyces hygroscopicus (уровень сходства 99%, Приложение 2).
Вид Streptomyces hygroscopicus (Jensen 1931) Yüntsen et al. 1956 относится к царству Bacteria, типу Actinobacteria, классу Actinobacteria, порядку Actinomycetales, семейству Streptomycetaceae, роду Streptomyces. Описан в 1931 году [Jensen, 1931]. Согласно литературным данным, S. hygroscopicus синтезирует антибиотики гелданамицин, гигромицин Б, нигерицин, валидомицин, циклотиазомицин.
Антибиотик гелданамицин ингибирует в клетках-мишенях функцию протеина теплового шока HSP90, которые играют важную роль в регуляции роста и выживания клеток, а также клеточного цикла, в том числе – апоптоза благодаря этому данный антибиотик и его синтетические аналоги используются в противоопухолевой терапии [Bedin et al., 2004].
Антибиотик гигромицин Б ингибирует синтез полипептидов в клетках-мишенях благодаря стабилизации сайта, ответственного за присоединение транспортной РНК в рибосомах. Активен против ряда бактерий, а также против эукариотических клеток, включая клетки грибов и высших эукариотов [Pettinger et al., 1953]. Используется в ветеринарной медицине в качестве противогельминтного средства.
Антибиотик нигерицин влияет на ионный транспорт и АТФазную активность в митохондриях, действуя как ионофор [Graven et al., 1966]. Активен в отношении прокариотических (грамположительные бактерии) и эукариотических клеток.
Антибиотик валидомицин является ингибитором трегалазы (фермента, гидролизующего трегалозу до глюкозы) [Li et al., 2011]. Используется в качестве фунгицида для борьбы с ожогом риса, вызываемым Rhizoctonia solani [Ganesha Naik et al., 2017].
Антибиотик циклотиазомицин является ингибитором РНК-полимеразы [Hashimoto et al., 2006]. Показано, что данный антибиотик проявляет антигрибную активность, в том числе – против фитопатогенных грибов, благодаря нарушению структуры клеточной стенки из-за связывания с молекулами хитина, входящими в состав грибной клеточной стенки [Mizuhara, 2011].
Кроме антибиотической активности, для S. hygroscopicus показана способность стимулировать рост растений за счёт выделения соединений с ауксиноподобным действием [Igarashi et al., 2002]. В последние годы S. hygroscopicus рассматривается как перспективный агент для биологической борьбы с грибными болезнями сельскохозяйственных растений, хотя число обнаруженных нами работ на эту тему на текущий момент крайне невелико [Shen et al., 2016; Mitrović et al., 2017; Grahovac et al., 2020].
Заключение по главе 4
В ходе лабораторных исследований из автохтонных почвенных и ризосферных микробных сообществ выделены 23 бактериальных штамма, проявляющие антибиотическую активности в отношении широкого спектра фитопатогенных грибов в условиях in vitro. Среди выделенных штаммов 22 представлены спорообразующими грамположительными палочками сем. Bacillaceae либо актинобактериями. Актинобактерии, несмотря на низкую скорость роста в сравнении с представителями сем. Bacillaceae, как правило, демонстрировали существенно более высокий уровень антигрибной активности.
Два наиболее эффективных штамма идентифицированы методом секвенирования гена 16S рРНК как представители вида Bacillus atrophaeus Nakamura 1989 (штамм RSA-1) и вида Streptomyces hygroscopicus (Jensen 1931) Yüntsen et al. 1956 (штамм RSA-13).
Штаммы RSA-1 и RSA-13 эффективно подавляют развитие актуальных для региона фитопатогенных и факультативно фитопатогенных грибов, относящихся к трём отделам (Zygomycota, Ascomycota, Basidiomycota), а также развитие грибоподобных протистов (отдел Oomycota) в условиях in vitro. В этой связи оба штамма были использованы в лабораторных испытаниях в качестве биологических агентов для защиты сои от грибных болезней.
5 Лабораторные испытания эффективности штаммов-антагонистов в защите сои от грибных болезней
Проверку эффективности штаммов-антагонистов в защите сои от грибных болезней в лабораторных условиях проводили по схеме полного факторного эксперимента методом рулонных культур. В качестве факторов служили искусственное заражение грибами р. Fusarium и бактеризация. Фактор “заражение” имел два уровня (нет заражения; есть заражение), фактор “бактеризация” имел три уровня (нет бактеризации; бактеризация штаммом RSA-1; бактеризация штаммом RSA-13). Для сравнения эффекта бактеризации с химическими препаратами использовали протравитель Оплот в двух вариантах – без искусственного заражения и с искусственным заражением. В каждом варианте эксперимента было по 4 повторности по 50 растений в каждой повторности, итого – по 200 растений на каждый вариант.
5.1 Влияние бактеризации на распространённость грибных болезней сои в лабораторных условиях
Искусственное заражение статистически значимо (p<0,001) повысило распространённость как фузариоза, так и других инфекций (рис. 5.1, 5.2).
Рисунок 5.1 – Распространённость инфекции проростков сои без искусственного заражения грибами р. Fusarium (в среднем по вариантам)
Рисунок 5.2 – Распространённость инфекции проростков сои на фоне искусственного заражения грибами р. Fusarium (в среднем по вариантам)
Между распространённостью фузариоза и распространённостью других заболеваний отмечена статистически значимая (p<0,05) положительная (r=0,793) корреляция (рис. 5.3).
Рисунок 5.3 – Связь между распространённостью фузариоза и распространённостью прочих заболеваний проростков сои в лабораторном эксперименте (каждая точка соответствует варианту эксперимента)
Данные по распространённости заболеваний сои по отдельным вариантам лабораторного эксперимента представлены на рисунках 5.4-5.11.
Рисунок 5.4 – Распространённость инфекции проростков сои в контроле
Рисунок 5.5 – Распространённость инфекции проростков сои на фоне искусственного заражения фузариозом
Рисунок 5.6 – Распространённость инфекции проростков сои при бактеризации штаммом RSA-1 без искусственного заражения фузариозом
Рисунок 5.7 – Распространённость инфекции проростков сои при бактеризации штаммом RSA-1 на фоне искусственного заражения фузариозом
Рисунок 5.8 – Распространённость инфекции проростков сои при бактеризации штаммом RSA-13 без искусственного заражения фузариозом
Рисунок 5.9 – Распространённость инфекции проростков сои при бактеризации штаммом RSA-13 на фоне искусственного заражения фузариозом
Рисунок 5.10 – Распространённость инфекции проростков сои при обработке препаратом Оплот без искусственного заражения фузариозом
Рисунок 5.11 – Распространённость инфекции проростков сои при обработке препаратом Оплот на фоне искусственного заражения фузариозом Положительная связь между развитием фузариоза и развитием других инфекций, очевидно, связана с тем, что ослабленные фузариозом растения становятся более восприимчивыми к другим фитопатогенам, в результате чего развиваются заболевания сложной этиологии. Подобное явление, в том числе применительно к грибам р. Fusarium, отмечается многими авторами [Li, Yang,, 2009; Иващенко, 2015; Саламатин, Новиков, 2016; Заостровных, Кадуров, 2018; Безмутко, Черепанова, 2020].
Как видно из представленных данных, распространённость фузариоза за счёт естественной заражённости семян в контроле составила 61,5%. Бактеризация штаммом RSA-1 снизила этот показатель в 1,7 раза, или на 25 процентных пунктов. Бактеризация штаммом RSA-13 снизила распространённость фузариоза в 2,1 раза, или на 32 процентных пункта. Результаты бактеризации оказались сопоставимы с действием химического протравителя Оплот, который в отсутствии искусственного заражения снизил распространённость фузариоза в 2,8 раза, или на 39,5 процентных пунктов (табл. 5.1).
Искусственное заражение грибами р. Fusarium статистически значимо (p<0,001 по точному F-тесту для таблиц 2х2) повысило распространённость фузариоза в варианте без обработки штаммами-антагонистами и протравителем до 83,5%. Бактеризация штаммом RSA-1 снизила распространённость фузариоза на воне искусственного заражения в 1,5 раза, или на 29 процентных пунктов, что сопоставимо с эффектом химического протравителя Оплот, который на фоне искусственного заражения снизил распространённость фузариоза в 2,1 раза, или на 43 процентных пункта. Бактеризация штаммом RSA-13 на фоне искусственного заражаения семян грибами р. Fusarium не привела к снижению распространённости фузариоза (см. табл. 5.1), однако существенно снизила вредоносность заболевания, что нашло отражение в увеличении роста проростков (раздел 5.2).
Таблица 5.1 – Влияние бактеризации и обработки химическим протравителем на распространённость фузариоза в лабораторных условиях
| Вариант обработки | Снижение распространённости фузариоза в сравнении с вариантом без обработки | ||
| раз | процентных пунктов | значимость отличий от варианта без обработки | |
| Без искусственного заражения фузариозом | |||
| RSA-1 | 1,7 | 25 | <0,001 |
| RSA-13 | 2,1 | 32 | <0,001 |
| Оплот | 2,8 | 39,5 | <0,001 |
| На фоне искусственного заражения фузариозом | |||
| Fusarium+RSA-1 | 1,5 | 29 | <0,001 |
| Fusarium+RSA-13 | 1,0 | 1 | нет |
| Fusarium+Оплот | 2,1 | 43 | <0,001 |
5.2. Влияние бактеризации на рост проростков сои в лабораторных условиях
При изучение биометрических показателей проростков установлено, что препарат Оплот оказал сильное ретардантное действие, выразившееся в статистически значимом (p<0,001) угнетении роста проростков (рис. 5.12). Этот эффект наблюдался как в отсутствии искусственного заражения, так и на фоне искусственного заражения фузариозом. Следует отметить, что подобное действие препарата Оплот не заявлено производителем. Напротив, в описании одного из компонентов препарата (дифеноконазола) на сайте Пестициды.ру (https://www.pesticidy.ru/active_substance/difenoconazole) со ссылкой на [Гаврилов, 1996] указано, что данное соединение ускоряет прорастание семян. Касательно второго компонента данного препарата (тебуконазола) на том же сайте со ссылкой на [Тютерев, 2005] отмечается, что данное соединение может проявлять ретардантный эффект при неблагоприятных условиях, к которым, в частности, относится недостаток влаги. Поскольку лабораторные эксперименты выполнялись методом рулонных культур в строгом соответствии с ГОСТ 12038-84 “Семена сельскохозяйственных культур. Методы определения всхожести”, неблагоприятные условия в качестве причины наблюдавшегося при обработке препаратом Оплот угнетения роста проростков следует исключить.

Рисунок 5.12 – Угнетающее действие протравителя Оплот на рост проростков сои в лабораторных условиях: 1 – контроль, 2- опыт
Бактеризация штаммами RSA-1 и RSA-13, напротив, привела к увеличению роста проростков сои, что особенно ярко проявилось на фоне искусственного заражения грибами р. Fusarium (рис. 5.13).
Рисунок 5.13 – Средняя длина проростков в разных вариантах эксперимента. Полосы погрешности обозначают 95%-е доверительные интервалы для среднего.
Двухфакторный дисперсионный анализ подтвердил статистическую значимость эффектов факторов “искусственное заражение фузариозом” (p<0,001) и “бактеризация” (p<0,001) на среднюю длину проростков, а также эффект взаимодействия факторов (p<0,01) (рис. 5.14, 5.15)
Рисунок 5.14 – Влияние факторов “заражение” и “бактеризация” на длину проростков сои.
Рисунок 5.15 – Взаимодействие факторов “заражение” и “бактеризация”.
Статистическая значимость различий между вариантами эксперимента по длине проростков согласно ранговому тесту Дункана показана в таблице 5.2. Как видно из представленных данных, бактеризация семян исследуемыми штаммами практически во всех случаях привела к статистически значимому увеличению средней длины проростков в сравнении с небактеризованными вариантами. Исключение составил вариант с бактеризацией штаммом RSA-1 при отсутствии искусственного заражения с фузариозом, где прибавка длины проростков, хотя и имела место, но оказалась статистически незначимой.
В целом увеличение длины проростков при бактеризации штаммом RSA-13 было более существенным, чем при бактеризации штаммом RSA-1. Так, при отсутствии искусственного заражения грибами р. Fusarium бактеризация штаммом RSA-13 привела к увеличению средней длины проростков сои на 10,1% (со 174,0 мм до 191,6 мм), а на фоне искусственного заражения – на 44,1% (с 93,2 мм до 134,3 мм).
При бактеризации штаммом RSA-1 увеличение длины проростков составило 2,0% в варианте без искусственного заражения, и 39,8% на фоне искусственного заражения.
Таблица 5.2 – Статистическая значимость различий между вариантами эксперимента по длине проростков по ранговому тесту Дункана
| № варианта | Заражение | Бактериза-ция | № варианта | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |||
| Средняя длина проростков, мм | ||||||||
| 174,0 | 177,4 | 191,6 | 93,2 | 130,3 | 134,3 | |||
| 1 | нет | нет | 0,630 | 0,016 | 0,000 | 0,000 | 0,000 | |
| 2 | нет | RSA-1 | 0,630 | 0,042 | 0,000 | 0,000 | 0,000 | |
| 3 | нет | RSA-13 | 0,016 | 0,042 | 0,000 | 0,000 | 0,000 | |
| 4 | есть | нет | 0,000 | 0,000 | 0,000 | 0,000 | 0,000 | |
| 5 | есть | RSA-1 | 0,000 | 0,000 | 0,000 | 0,000 | 0,573 | |
| 6 | есть | RSA-13 | 0,000 | 0,000 | 0,000 | 0,000 | 0,573 | |
Увеличение длины проростков при бактеризации исследуемыми штаммами можно объяснить снижением распространённости и интенсивности развития фузариоза. Действительно, между развитием фузариоза и длиной проростков обнаружена статистически значимая отрицательная корреляционная связь. При вычислении коэффициента корреляции с использованием данных по отдельным повторностям коэффициент корреляции между распространённостью фузариоза и средней длиной растений в повторности равен –0,715, а его статистическая значимость p<0,001. При проведении корреляционного анализа по вариантам коэффициент корреляции между распространённостью фузариоза и средней длиной растений в варианте равен – 0,823, а его статистическая значимость p<0,05 (рис. 5.16, 5.17).
Рисунок 5.16 – Связь между распространённостью фузариоза и средней длиной проростков, каждая точка соответствует отдельной повторности.
Рисунок 5.17 – Связь между распространённостью фузариоза и средней длиной проростков, каждая точка соответствует отдельному варианту.
Заключение по главе 5
Лабораторные исследования показали, что бактеризация штаммом RSA-1 эффективно снижает распространённость фузариоза и других заболеваний сои как в отсутствии искусственного заражения грибами р. Fusarium, так и на фоне искусственного заражения. При отсутствии искусственного заражения распространённость инфекции снижается в 1,7 раза, на фоне искусственного заражения – в 1,5 раза. В обоих случаях эффект статистически значим на уровне p<0,001. Снижение распространённости инфекции на фоне искусственного заражения фузариозом сопровождается статистически значимым (p<0,001) увеличением средней длины проростков на 39,8%.
Бактеризация штаммом RSA-13 при отсутствии искусственного заражения грибами р. Fusarium снижает распространённость инфекции в 2,1 раза, статистическая значимость эффекта составляет p<0,001. Снижение распространённости заболевания сопровождается статистически значимым (p<0,05) увеличением средней длины проростков на 10,1%. На фоне искусственного заражения фузариозом бактеризация штаммом RSA-13 не снижает распространённость инфекции, однако снижает её вредоносность, что находит отражение в статистически значимом (p<0,001) увеличении средней длины проростков на 44,1%.
По результатам лабораторных исследований оба штамма были допущены до полевых испытаний.
6 Протоколы культивирования наиболее эффективных штаммов-антагонистов
В качестве питательных сред для культивирования штаммов RSA-1 и RSA-13 были апробированы среды следующего состава.
- Среда №2 ГРМ (Сабуро) производства ФБУН ГНЦ ПМБ (панкреатический гидролизат рыбной муки – 10,0 г/л, панкреатический гидролизат казеина – 10,0 г/л, дрожжевой экстракт – 2,0 г/л, натрия фосфат однозамещенный – 2,0 г/л, глюкоза – 40,0 г/л) в разведении 1:1.
- Среда Чапека-Докса (сахароза – 20,0 г/л, нитрат натрия – 2,0 г/л, фосфат калия двузамещенный – 1,0 г/л, сульфат магния – 0,5 г/л, хлорид калия – 0,5 г/л, сульфат железа – 0,01 г/л).
- Пептон основной производства ФБУН ГНЦ ПМБ (20 г/л).
При выращивании на плотных средах в качестве отвердителя использовали агар (20 г/л). При выращивании на жидких средах агар не добавляли. Перед использованием среды автоклавировали при 1 избыточной атмосфере (121ºС) в течение 30 минут. В качестве показателей учитывали размеры колоний на плотной питательной среде на момент завершения цикла развития и количество образовавшихся спор на единицу площади.
Установлено, что штамм RSA-1 способен к росту на всех испытанных средах. На среде №2 ГРМ (Сабуро) в разведении 1:1 формируются плоские колонии бежевого цвета диаметром до 40 мм со слабоморщинистой поверхностью и ризоидным краем (рис. 6.1, 6.2). На среде с пептоном формируются выпуклые колонии чёрного цвета диаметром 10-11 мм со складчатой поверхностью и фестончатым краем (рис. 6.3). На среде Чапека-Докса колонии выпуклые, бесцветные с розовым центром, диаметром 11-12 мм, со складчатой поверхностью и ровным краем (рис. 6.4).
Изучение цикла развития показало, что на среде №2 ГРМ (Сабуро) и на среде с пептоном штамм RSA-1 проходит полный цикл развития, завершающийся 100%-ным образованием эндоспор.
На среде Чапека-Докса образование эндоспор нарушено. По завершении цикла развития культуры лишь 10-15% клеток формируют эндоспоры, остальные клетки после истощения питательной среды погибают без формирования эндоспор (рис. 6.5).
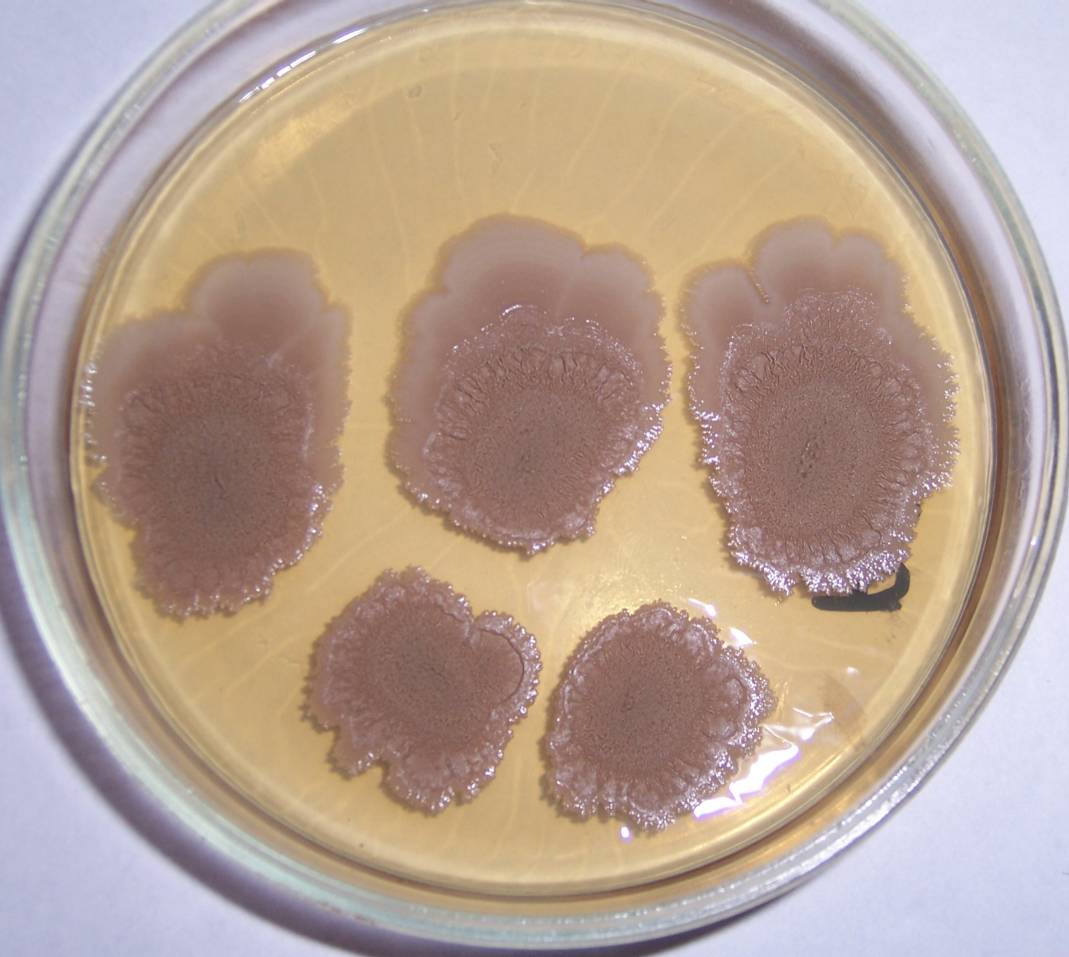
Рисунок 6.1 – Общий вид колоний штамма RSA-1 на среде №2 ГРМ в разведении 1:1
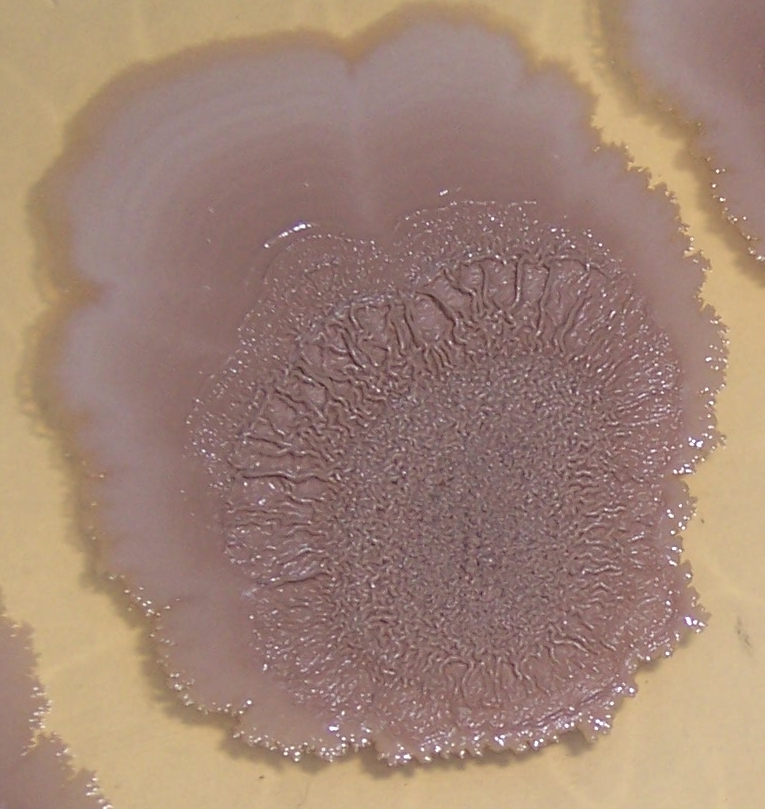
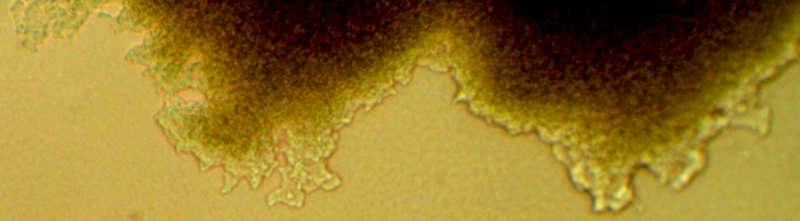
Рисунок 6.2 – Структура колоний штамма RSA-1 на среде №2 ГРМ в разведении 1:1. Внизу – край колонии под микроскопом (объектив 10х)
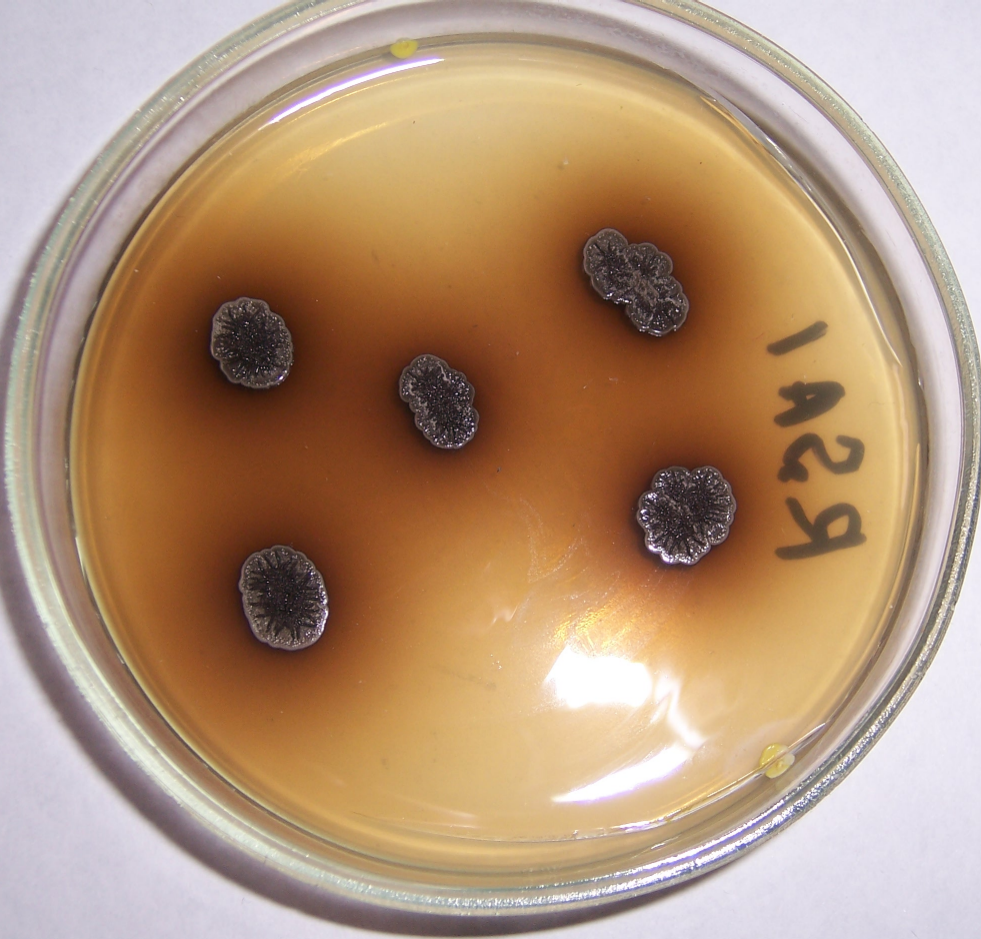
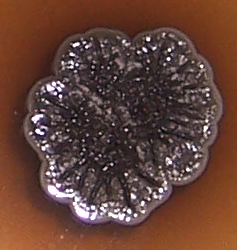
Рисунок 6.3 – Общий вид и структура колоний штамма RSA-1 на среде с пептоном
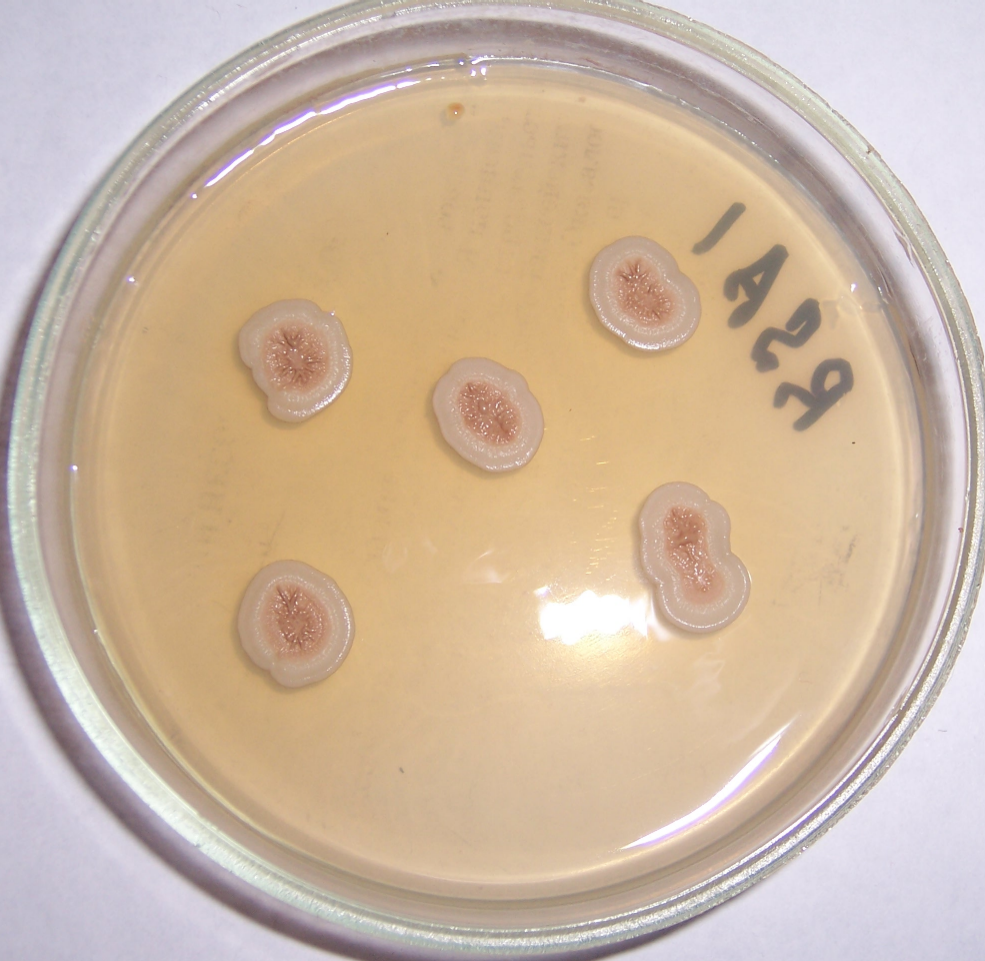
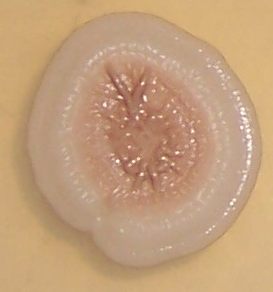
Рисунок 6.4 – Общий вид и структура колоний штамма RSA-1 на среде Чапека-Докса
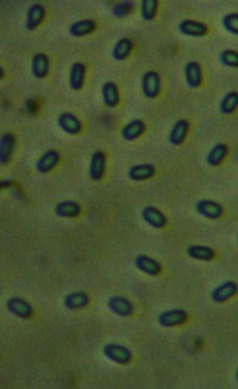
1 2
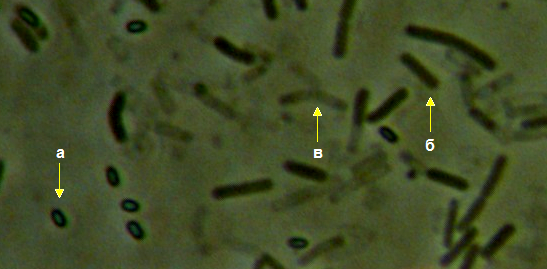
3
Рисунок 6.5 – Внешний вид культуры штамма RSA-1 при выращивании на разных средах после окончания цикла развития: 1 – среда среде №2 ГРМ в разведении 1:1; 2 – пептон 20 г/л; 3 – среда Чапека-Докса. а – споры; б – вегетативные клетки; в – отмершие вегетативные клетки, не сформировавшие споры
Несмотря на то, что площадь колоний штамма RSA-1 на среде с пептоном в 13-16 раз меньше, чем на среде №2 ГРМ (Сабуро) в разведении 1:1, это не сказывается на продуктивности культуры в плане производства эндопор. Напротив, благодаря существенно большей толщине колоний на среде с пептоном продуктивность на 1 см 2 оказывается в три раза выше, чем на среде №2 ГРМ (Сабуро) (табл. 6.1).
Таблица 6.1 – Продуктивность штамма RSA-1 в плане производства эндоспор на среде №2 ГРМ (Сабуро) в разведении 1:1 и на среде с пептоном; 95%-е доверительные интервалы рассчитаны с помощью программы GraphPad’s QuickCalcs согласно [Patil, Kulkarni, 2012].
| Показатель | Среда №2 ГРМ (Сабуро) в разведении 1:1 | Среда с пептоном |
| Число спор в пересчёте на 1 см 2 | 1,86х10 8 .. 2,03х10 8 | 5,67 х10 8 .. 6,44 х10 8 |
| Число спор в пересчёте на чашку Петри при посеве “газоном” | 1,18х10 10 .. 1,28х10 10 | 3,61х10 10 ..4,10х10 10 |
| Число чашек Петри для приготовления 1 л суспензии с титром 10 7 спор на мл | 0,85..0,78 | 0,28..0,24 |
| Число чашек Петри для обработки 1 т семян при расходе 10 л споровой суспензии на тонну. | 7..8 | 2..3 |
Таким образом, при выращивании штамма RSA-1 на чашках Петри для бактеризации 1 т семян при использовании среды №2 ГРМ потребуется 7-8 чашек Петри, при использовании среды с Пептоном – 2-3 чашки Петри.
При выращивании на жидких средах того же состава штамм RSA-1 хорошо развивается и образует эндоспоры на среде №2 ГРМ в разведении 1:1 и на среде с пептоном. На среде Чапека-Докса прорастание спор заторможено (рис. 6.6, 6.7).
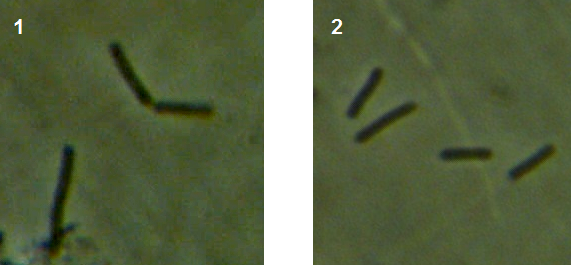
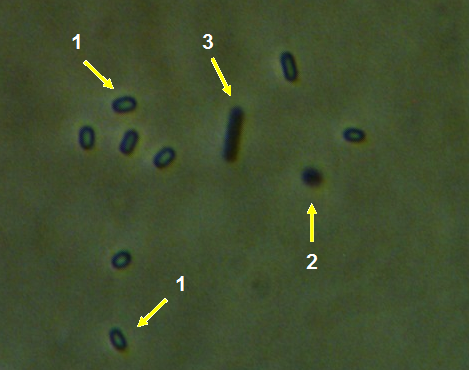
Рисунок 6.6 – Жидкая культура штамма RSA-1 через 12 часов после засева споровой суспензией: 1 – среда №2 ГРМ в разведении 1:1, 2 – среда с пептоном.
Рисунок 6.7 – Жидкая культура штамма RSA-1 через 12 часов после засева споровой суспензией на среде Чапека-Докса: 1 – непроросшие споры, 2 – набухшая спора, 3 – вегетативные клетки.
На момент достижения стационарной фазы титр клеток на среде №2 ГРМ в разведении 1:1 и титр клеток на среде с пептоном практически одинаков. Рассчитанный согласно [Patil, Kulkarni, 2012] 95%-й доверительный интервал для среды №2 ГРМ составляет [5,82х10 8 ; 6,70 х10 8 ] клеток на 1 мл, для среды с пептоном [6,02х10 8 ; 6,91х10 8 ] клеток на 1 мл. После истощения питательной среды практически 100% клеток формируют эндоспоры. Таким образом, 1 л жидкой культуры достаточно для бактеризации 6 т семян из расчёта 10 л на 1 т при титре рабочей суспензии 10 7 клеток на мл. На среде Чапека-Докса на момент достижения стационарной фазы титр клеток почти в 2,5 раза ниже, чем на среде №2 ГРМ и на среде с пептоном; доверительный интервал составляет [1,50х10 8 ; 1,96х10 8 ] клеток на 1 мл, к образованию спор способны не более 15% клеток.
На основе полученных результатов для производства биопрепарата на основе штамма RSA-1 мы рекомендуем использовать среду №2 ГРМ в разведении 1:1 или среду с пептоном (20 г/л). При приготовлении пилотных партий препарата для обработки семян при посевных площадях в десятки гектар (при существующей норме высева 55-80 кг/га в зависимости от сорта) лучше использовать агаризованные среды. Выращивание на агаризованных средах является технически простым, не требует наличия ферментёра, устойчиво к контаминации посторонними микроорганизмами. Для промышленных партий необходимо использовать глубинное культивирование на жидких средах того же состава.
Штамм RSA-13 при выращивании на плотных средах одинаково хорошо растёт на среде №2 ГРМ и на среде Чапека-Докса. На обеих средах формируются однотипные выпуклые колонии диаметром 10-12 мм с хорошо развитым воздушным мицелием с органами спороношения (рис. 6.8 – 6.9).
На среде с пептоном рост штамма RSA-13 скудный. Диаметр колоний не превышает 5 мм, профиль колоний – плоский, воздушный мицелий с органами спороношения не образуется (рис. 6.10).


Рисунок 6.8 – Внешний вид и структура колоний штамма RSA-13 на среде №2 ГРМ в разведении 1:1. Внизу – край колонии под микроскопом (объектив 10х)
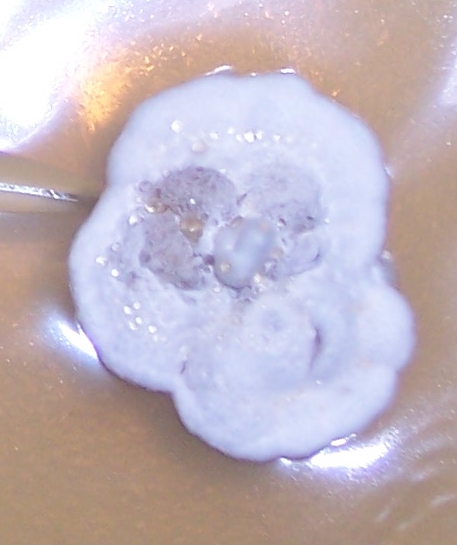
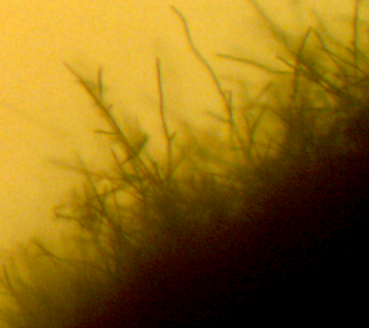
Рисунок 6.9 – Структура колоний штамма RSA-1 на среде Чапека-Докса. Внизу – край колонии под микроскопом (объектив 10х)
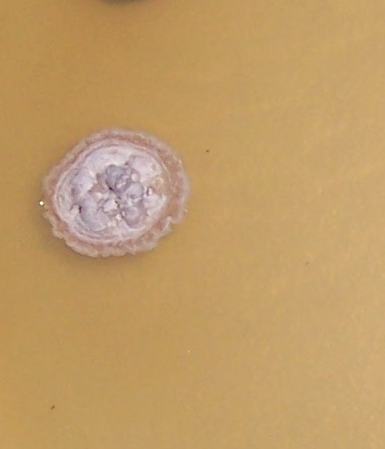
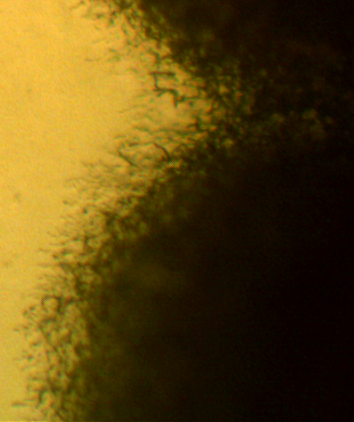
Рисунок 6.10 – Структура колоний штамма RSA-1 на среде с пептоном. Внизу – край колонии под микроскопом (объектив 10х)
Продуктивность штамма RSA-13 на среде №2 ГРМ (Сабуро) в разведении 1:1 и на среде Чапека-Докса в плане производства спор оказалась практически идентичной (табл. 6.2), статистически значимые различия отсутствуют.
Таблица 6.2 – Продуктивность штамма RSA-13 в плане производства эндоспор на среде №2 ГРМ (Сабуро) в разведении 1:1 и на среде с пептоном; 95%-е доверительные интервалы рассчитаны с помощью программы GraphPad’s QuickCalcs согласно [Patil, Kulkarni, 2012].
| Показатель | Среда №2 ГРМ (Сабуро) в разведении 1:1 | Среда Чапека-Докса |
| Число спор в пересчёте на 1 см 2 | 1,68х10 8 .. 2,22х10 8 | 1,64х10 8 .. 2,18х10 8 |
| Число спор в пересчёте на чашку Петри при посеве “газоном” | 1,07х10 10 ..1,41х10 10 | 1,05х10 10 .. 1,39х10 10 |
| Число чашек Петри для приготовления 1 л суспензии с титром 10 7 спор на мл | 0,93..0,71 | 0,95..0,72 |
| Число чашек Петри для обработки 1 т семян при расходе 10 л споровой суспензии на тонну. | 7..10 | 7..10 |
При глубинном культивировании штамма RSA-13 на жидкой питательной среде основной проблемой является медленный рост штамма вкупе с замедленным спорообразованием, что совпадает с литературными данными для р. Streptomyces [Патент RU2127521C1, 1999]. В этой связи для производства пилотных партий биопрепарата на основе штамма RSA-13 для обработки семян при посевных площадях в десятки гектар мы рекомендуем использовать агаризованную среду Чапека-Докса, как более дешёвую в сравнении со средой №2 ГРМ (Сабуро).
Заключение по главе 6
Для приготовления пилотных партий биопрепарата на основе штамма RSA-1 при посевных площадях в десятки гектар рекомендуется следующий протокол культивирования:
- Культура рассевается “газоном” в чашки Петри с питательной средой №2 ГРМ (Сабуро) в разведении 1:1 либо со средой, содержащей 20 г/л пептона. В обоих вариантах содержание агара в среде должно составлять 20 г/л. Рекомендуется использовать агар пищевой, как более дешёвый в сравнении с агаром микробиологическим, и содержащий дополнительные факторы роста в силу низкой степени очистки. Для обработки 1 тонны семян требуется от трёх (в случае среды с пептоном) до восьми (в случае среды №2 ГРМ) чашек Петри.
- Чашки инкубируются при комнатной температуре (24-27ºC) в течение 7 суток до завершения роста культуры и массового образования эндоспор. Образование эндоспор контролируется микроскопическим путём.
- После споруляции культуры материал смывается стерильной водопроводной водой и (в случае немедленного применения) разводится из расчёта 3 (в случае среды с пептоном) или 8 (в случае среды №2 ГРМ) чашки Петри на 10 л воды. В случае, если препарат подлежит длительному хранению, смыв осуществляется небольшим количеством воды (рекомендуемый объём – 20 мл на чашку Петри), полученная суспензия хранится в холодильнике в герметично закрытой таре при температуре от 4 до 10-12ºС. Перед применением суспензия разводится водопроводной водой из расчёта – смыв с трёх (в случае среды с пептоном) или с восьми (в случае среды №2 ГРМ) чашки Петри на 10 л воды.
Для приготовления пилотных партий биопрепарата на основе штамма RSA-13 при посевных площадях в десятки гектар рекомендуется следующий протокол культивирования:
- Культура рассевается “газоном” в чашки Петри с питательной средой Чапека-Докса, содержание агара в среде должно составлять 20 г/л. Рекомендуется использовать агар пищевой, как более дешёвый в сравнении с агаром микробиологическим, и содержащий дополнительные факторы роста в силу низкой степени очистки. Для обработки 1 тонны семян требуется 10 чашек Петри.
- Чашки инкубируются при комнатной температуре (24-27ºC) в течение 14 суток до завершения роста культуры и массового образования спор. Образование спор контролируется микроскопическим путём либо по появлению характерного белого мучнистого налёта на поверхности колоний.
- После споруляции культуры материал смывается стерильной водопроводной водой и (в случае немедленного применения) разводится из расчёта 10 чашек Петри на 10 л воды. В случае, если препарат подлежит длительному хранению, смыв осуществляется небольшим количеством воды (рекомендуемый объём – 20 мл на чашку Петри), полученная суспензия хранится в холодильнике в герметично закрытой таре при температуре от 4 до 10-12ºС. Перед применением суспензия разводится водопроводной водой из расчёта – смыв с десяти чашек Петри на 10 л воды.
Бактеризация семян обоими штаммами осуществляется путём обработки споровой суспензией из расчёта 10 л на 1 т семян. Обработка осуществляется по той же методике и с использованием того же оборудования, которые применяются для протравливания семян химическими фунгицидами.
7 Полевые испытания штаммов-антагонистов
В вегетационный сезон 2020 г. была проведена оценка возможности совместного применения штаммов бактерий-антагонистов, подавляющих развитие грибных болезней сои, и штамма нативной клубеньковой азотфиксирующей культуры. Работа выполнена в полевом эксперименте на сортах Заряница и Эос в следующих вариантах: обработка штаммом азотфиксаторов (контроль), совместная инокуляция нативным клубеньковым штаммом и штаммом антагонистом RSA-1, совместная инокуляция нативным клубеньковым штаммом RSA-13. Посев сои проведён 22 мая, учёт интенсивности развития грибных болезней и анализ биометрических показателей проведён в середине вегетационного периода 17 июля (по 20 случайным образом отобранных растений в каждом варианте), в конце вегетации проведён учёт урожая и его структуры.
7.1 Влияние штаммов-антагонистов на интенсивность грибных болезней сои в полевых условиях
Средняя интенсивность развития грибных болезней в середине вегетационного периода в контроле (без бактеризации штаммами-антагонистами) составила 75,5% для сорта Эос и 70,5% для сорта Заряница. Различия между сортами по данному показателю статистически незначимы.
Оба штамма статистически значимо (p<0,001) снизили интенсивность развития болезней. Так, штамм RSA-1 снизил среднюю интенсивность развития болезней у сорта Эос до 57,25% (в 1,32 раза, или на 18,25 процентных пунктов), штамм RSA-13 – до 55,45% (в 1,36 раза, или на 20,05 процентных пунктов). У сорта Заряница штамм RSA-1 снизил интенсивность развития болезней до 63,0% (в 1,12 раза, или на 7,5 процентных пунктов), штамм RSA-13 – до 60,25% (в 1,17 раза, или на 10,25 процентных пунктов).
Двухфакторный дисперсионный анализ показал, что эффект фактора “сорт”, а также эффект взаимодействия факторов “сорт” и “бактеризация” является статистически незначимым, в то время как эффект фактора “бактеризация” является в высшей степени значимым (рис. 7.1, 7.2).
Рисунок 7.1 – Влияние факторов “сорт” и “бактеризация” на интенсивность развития болезней сои в полевых условиях.
Рисунок 7.2 – Эффект взаимодействия факторов “сорт” и “бактеризация”
Статистическая значимость различий между вариантами эксперимента по интенсивности согласно ранговому тесту Дункана показана в таблице 7.1.
Таблица 7.1 – Статистическая значимость различий между вариантами эксперимента по интенсивности развития болезней по ранговому тесту Дункана
| № варианта | Сорт | Бактериза-ция | № варианта | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |||
| Интенсивность развития болезней, % | ||||||||
| 75,50 | 57,25 | 55,45 | 70,50 | 63,00 | 60,25 | |||
| 1 | Эос | нет | 0,000 | 0,000 | 0,274 | 0,010 | 0,002 | |
| 2 | Эос | RSA-1 | 0,000 | 0,693 | 0,007 | 0,237 | 0,511 | |
| 3 | Эос | RSA-13 | 0,000 | 0,693 | 0,003 | 0,133 | 0,324 | |
| 4 | Заряница | нет | 0,274 | 0,007 | 0,003 | 0,102 | 0,034 | |
| 5 | Заряница | RSA-1 | 0,010 | 0,237 | 0,133 | 0,102 | 0,547 | |
| 6 | Заряница | RSA-13 | 0,002 | 0,511 | 0,324 | 0,034 | 0,547 | |
Как видно из представленных данных, статистическая значимость снижения развития болезней при бактеризации сорта Эос штаммами RSA-1 и RSA-13 составляет p<0,001. При бактеризации сорта Заряница статистическая значимость снижения развития болезней составляет p=0,01 для штамма RSA-1, и p<0,01 для штамма RSA-13. Статистически значимые различия между эффективностью штаммов для обоих сортов отсутствуют.
Снижение интенсивности развития болезней в результате бактеризации штаммами-антагонистами положительно сказалось на росте растений. Так, у сорта Эос при отсутствии бактеризации средняя высота растений составила 28,5 см. Бактеризация штаммом RSA-1 увеличила этот показатель до 35,35 см (в 1,24 раза), бактеризация штаммом RSA-13 – до 34,45 см (в 1,21 раза). У сорта Заряница при отсутствии бактеризации средняя высота растений составила 29,25 см. Бактеризация штаммом RSA-1 увеличила этот показатель до 35,75 см (в 1,22 раза), бактеризация штаммом RSA-13 – до 30,4 см (в 1,04 раза). Статистическая значимость различий между вариантами эксперимента по высоте растений согласно ранговому тесту Дункана показана в таблице 7.2.
Таблица 7.2 – Статистическая значимость различий между вариантами эксперимента по высоте растений по ранговому тесту Дункана
| № варианта | Сорт | Бактериза-ция | № варианта | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |||
| Высота растений, см | ||||||||
| 28,5 | 35,35 | 34,45 | 29,25 | 35,75 | 30,4 | |||
| 1 | Эос | нет | 0,000 | 0,000 | 0,485 | 0,000 | 0,096 | |
| 2 | Эос | RSA-1 | 0,000 | 0,403 | 0,000 | 0,710 | 0,000 | |
| 3 | Эос | RSA-13 | 0,000 | 0,403 | 0,000 | 0,257 | 0,000 | |
| 4 | Заряница | нет | 0,485 | 0,000 | 0,000 | 0,000 | 0,285 | |
| 5 | Заряница | RSA-1 | 0,000 | 0,710 | 0,257 | 0,000 | 0,000 | |
| 6 | Заряница | RSA-13 | 0,096 | 0,000 | 0,000 | 0,285 | 0,000 | |
Как видно из представленных данных, увеличение высоты растений при бактеризации сорта Эос обоими штаммами является в высшей степени статистически значимым (p<0,001). При бактеризации сорта Заряница штаммом RSA-1 увеличение высоты растений также в высшей степени значимо (p<0,001), в то время как эффект штамма RSA-13 не доказан (p<0,10), что нашло своё отражение в статистически значимом (p<0,01) эффекте взаимодействия факторов “сорт” и “бактеризация” (рис. 7.3).
Рисунок 7.3 – Эффект взаимодействия факторов “сорт” и “бактеризация”.
Индивидуальные эффекты факторов “сорт” и “бактеризация” на высоту растений представлены на рис. 7.4. Как видно из представленных данных, эффект фактора “сорт” статистически незначим, в то время как эффект бактеризации значим на уровне p<0,001.
Рисунок 7.4 – Влияние факторов “сорт” и “бактеризация” на высоту растений.
Кроме высоты растений, бактеризация оказала стимулирующее действие и на накопление биомассы. Более отзывчивым на бактеризацию оказался сорт Эос. Так, если в контроле средняя масса растений была 12,53 г, то в результате бактеризации штаммом RSA-1 этот показатель увеличился до 15,2 г (прирост в 1,21 раза), а в результате бактеризации штаммом RSA-13 – до 15,02 г (прирост в 1,20 раза).
Сорт Заряница отреагировал на бактеризацию штаммом RSA-1 увеличением средней массы растений с 14,08 г до 19,03 г (прирост в 1,35 раза), в то время как бактеризация штаммом RSA-13 не повлияла на биомассу, что нашло отражение в статистически значимом (p<0,05) эффекте взаимодействия факторов “сорт” и “бактеризация” (рис. 7.5).
Рисунок 7.5 – Эффект взаимодействия факторов “сорт” и “бактеризация”.
Эффекты индивидуальных факторов представлены на рисунке 7.6, значимость различий между отдельными вариантами – в таблице 7.3.
Рисунок 7.6 – Влияние факторов “сорт” и “бактеризация” на массу растений.
Таблица 7.3 – Статистическая значимость различий между вариантами эксперимента по массе растений по ранговому тесту Дункана
| № варианта | Сорт | Бактериза-ция | № варианта | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |||
| Масса растений, г | ||||||||
| 12,53 | 15,20 | 15,02 | 14,08 | 19,03 | 13,96 | |||
| 1 | Эос | нет | 0,057 | 0,070 | 0,244 | 0,000 | 0,253 | |
| 2 | Эос | RSA-1 | 0,057 | 0,886 | 0,404 | 0,003 | 0,373 | |
| 3 | Эос | RSA-13 | 0,070 | 0,886 | 0,454 | 0,002 | 0,429 | |
| 4 | Заряница | нет | 0,244 | 0,404 | 0,454 | 0,000 | 0,922 | |
| 5 | Заряница | RSA-1 | 0,000 | 0,003 | 0,002 | 0,000 | 0,000 | |
| 6 | Заряница | RSA-13 | 0,253 | 0,373 | 0,429 | 0,922 | 0,000 | |
7.2 Влияние штаммов-антагонистов на нодуляцию сои в полевых условиях
На момент середины вегетации не отмечено негативного влияния исследуемых штаммов на нодуляцию сои. Напротив, штамм RSA-1 статистически значимо (p<0,001) повысил среднее число клубеньков на 1 растение у сорта Заряница (табл. 7.4, рис. 7.7, 7.8).
Рисунок 7.7 – Эффект взаимодействия факторов “сорт” и “бактеризация”.
Рисунок 7.8 – Влияние факторов “сорт” и “бактеризация” на нодуляцию сои.
Таблица 7.4 – Статистическая значимость различий между вариантами эксперимента по среднему числу клубеньков на растение по ранговому тесту Дункана
| № варианта | Сорт | Бактериза-ция | № варианта | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |||
| Число клубеньков на растение, шт | ||||||||
| 26,25 | 20,35 | 18,65 | 37 | 63,1 | 31 | |||
| 1 | Эос | нет | 0,235 | 0,150 | 0,041 | 0,000 | 0,338 | |
| 2 | Эос | RSA-1 | 0,235 | 0,732 | 0,002 | 0,000 | 0,043 | |
| 3 | Эос | RSA-13 | 0,150 | 0,732 | 0,001 | 0,000 | 0,022 | |
| 4 | Заряница | нет | 0,041 | 0,002 | 0,001 | 0,000 | 0,227 | |
| 5 | Заряница | RSA-1 | 0,000 | 0,000 | 0,000 | 0,000 | 0,000 | |
| 6 | Заряница | RSA-13 | 0,338 | 0,043 | 0,022 | 0,227 | 0,000 | |
7.3 Влияние штаммов-антагонистов на урожай сои в полевых условиях.
Бактеризация обоими штаммами статистически значимо повысила урожайность сорта Эос. Так, если в контроле средняя урожайность составила 58 г/м 2 , то на фоне бактеризации штаммом RSA-1 этот показатель вырос до 82 г/м 2 (прибавка 41,4%), эффект статистически значим на уровне p<0,01. Бактеризация штаммом RSA-13 повысила урожайность до 79 г/м 2 (прибавка36,2%), эффект статистически значим на уровне p=0,01 (табл. 7.5). В целом бактеризация штаммами-антагонистами статистически значимо (p<0,01) повысила урожайность сои сорта Эос на 38,8% (рис. 7.9).
Реакция сорта Заряница на бактеризацию с точки зрения урожайности была менее выражена. Бактеризация штаммом RSA-1 не привела к статистически значимому изменению урожайности. Бактеризация штаммом RSA-13 повысила среднюю урожайность с 76,25 г/м 2 до 96 г/м 2 (прибавка 25,9%), однако статистическая значимость эффекта не доказана. Тем не менее, включение в дисперсионный комплекс дополнительных данных по урожайности сорта Заряница на фоне инокуляции разными штаммами клубеньковых бактерий показало, что вариант с бактеризацией штаммом RSA-13 статистически значимо (p<0,05) превосходит по урожайности совокупность вариантов, не подвергавшихся бактеризации данным штаммом-антагонистом (рис. 7.10).
Таблица 7.5 – Статистическая значимость различий между вариантами эксперимента для сорта Эос по урожайности по ранговому тесту Дункана
| Вариант | контроль | RSA 1 | RSA 13 |
| Урожайность, г/м 2 | |||
| 58 | 82 | 79 | |
| контроль | 0,006 | 0,010 | |
| RSA 1 | 0,006 | 0,653 | |
| RSA 13 | 0,010 | 0,653 | |
Рисунок 7.9 – Влияние бактеризации штаммами-антагонистами на урожайность сои сорта Эос.
Рисунок 7.10 – Влияние бактеризации штаммом RSA-13 на урожайность сои сорта Заряница. Для увеличения числа степеней свободы в вариант “нет” включены дополнительные данные по испытаниям сорта Заряница с различными штаммами клубеньковых бактерий, проводившимся параллельно на том же опытном поле.
Анализ структуры урожая с помощью дисперсионного анализа не выявил статистически значимых различий между вариантами с бактеризацией штаммами-антагонистами и контролем из-за высокого уровня дисперсии изучаемых показателей. Тем не менее, дискриминантный анализ, проведённый по всему комплексу показателей, выявил статистически значимые (p<0,05 для сорта Эос и p<0,001 для сорта Заряница) различия между вариантами эксперимента. Проекции вариантов на канонические переменные представлены на рис. 7.11.
Рисунок 7.11 – Проекции вариантов на канонические переменные.
Анализ коэффициентов в канонических уравнениях показал, что эффект бактеризации сорта Эос проявляется в первую очередь в увеличении числа бобов, а эффект бактеризации сорта Заряница – в увеличении числа продуктивных узлов и числа семян на одно растение.
Заключение по главе 7
В ходе полевых испытаний штаммы RSA-1 и RSA-13 статистически значимо снизили интенсивность развития грибных болезней сои в середине вегетационного периода. Более отзывчивым на бактеризацию штаммами-антагонистами оказался сорт Эос, у которого бактеризация штаммами RSA-1 и RSA-13 привела к снижению интенсивности развития болезней в 1,32-1,36 раза. У сорта Заряница снижение интенсивности грибных болезней было менее значительным – в 1,12-1,17 раз. Снижение интенсивности заболеваний в результате обработки штаммами-антагонистами сопровождалось статистически значимым увеличением высоты (на 21-24% в зависимости от варианта) и массы (на 20-35% в зависимости от варианта) растений. Исключение составил вариант “RSA-13 х сорт Заряница”, где увеличение высоты и массы растений было статистически незначимым. Изучаемые штаммы не оказали негативного влияния на нодуляцию сои, при этом бактеризация штаммом RSA-1 привела к увеличению числа клубеньков на одно растение у сорта Заряница на 70,5%. Бактеризация обоими штаммами статистически значимо повысила урожайность сои сорта Эос на 36,2-38,8%, а бактеризация штаммом RSA-13 также повысила урожайность сои сорта Заряница на 25,9%. Таким образом, оба штамма продемонстрировали высокую эффективность против грибных болезней в сочетании с отсутствием негативного эффекта в отношении нодуляции сои. На основании результатов полевых испытаний штаммы RSA-1 и RSA-13 рекомендуются в качестве биологических средств защиты сои от грибных болезней в условиях Сибири.
Заключение
Наиболее распространёнными и вредоносными возбудителями грибных болезней сои в Сибири и на Дальнем Востоке являются фитопатогенные грибы р. Fusarium – возбудители фузариоза. В зависимости от поражённых органов, фузариоз сои может проявляться в виде корневых гнилей, гибели точки роста, трахеомикозного увядания, листовой пятнистости, поражения гниения бобов и семян, синдрома внезапной гибели растений. Особенно ярко преобладание представителей р. Fusarium в патогенном комплексе сои проявляется в Приенисейской Сибири, где их распространённость в семенах достигает 60%, на корнях и клубеньках – до 100%, а интенсивность развития фузариоза растений в середине вегетации достигает 70-75%. Наряду с представителями р. Fusarium в патогенном комплексе сои в Приенисейской Сибири нами выявлены Cladosporium spp., Alternaria spp., Acremonium strictum, Rhizoctonia solani, Pythium spp., а в качестве возбудителей плесневения семян – представители родов Rhizopus, Aspergillus, Penicillium.
Грибные болезни сои, по разным оценкам, вызывают потерю 20-50% урожая. Несмотря на актуальность проблемы, биологические препараты, предназначенные для защиты сои в Сибири и на Дальнем Востоке, на отечественном рынке отсутствуют, а исследования в этом направлении в последние годы ограничиваются буквально двумя публикациями, в которых испытывались биопрепараты, разработанные в других регионах и предназначенные для других сельскохозяйственных культур. В то же время известно, что масимальный эффект в биологической защите сельскохозяйственных культур от болезней дают препараты на основе аборигенных штаммов, адаптированных к местным почвенно-климатическим условиям.
В ходе выполнения проекта нами составлена коллекция актуальных для региона возбудителей грибных болезней сои, которая была использована для тестирования штаммов-антагонистов.
В ходе лабораторных исследований из автохтонных почвенных и ризосферных микробных сообществ нами выделены 23 бактериальных штамма, проявляющие антибиотическую активности в отношении широкого спектра фитопатогенных грибов в условиях in vitro. Среди выделенных штаммов 22 представлены спорообразующими грамположительными палочками сем. Bacillaceae либо актинобактериями. Несмотря на относительно низкую скорость роста, актинобактерии, как правило, демонстрировали существенно более высокий уровень антигрибной активности, чем представители сем. Bacillaceae.
Два наиболее эффективных штамма (RSA-1 и RSA-13) идентифицированы методом секвенирования гена 16S рРНК соответственно как представители вида Bacillus atrophaeus Nakamura 1989 и вида Streptomyces hygroscopicus (Jensen 1931) Yüntsen et al. 1956.
Оба штамма эффективно подавляют развитие актуальных для региона фитопатогенных и факультативно фитопатогенных грибов, относящихся к трём отделам (Zygomycota, Ascomycota, Basidiomycota), а также развитие грибоподобных протистов (отдел Oomycota) в культуре in vitro. В лабораторных экспериментах, проводившихся методом рулонных культур, бактеризация семян штаммом RSA-1 статистически значимо (p<0,001) снизила распространённость фузариоза сои как в отсутствии искусственного заражения грибами р. Fusarium (в 1,7 раз), так и на фоне искусственного заражения (в 1,5 раза). Снижение распространённости инфекции на фоне искусственного заражения фузариозом сопровождалось статистически значимым (p<0,001) увеличением средней длины проростков на 39,8%.
Бактеризация штаммом RSA-13 при отсутствии искусственного заражения грибами р. Fusarium статистически значимо (p<0,001) снизила распространённость инфекции в 2,1 раза. Снижение распространённости заболевания сопровождалось статистически значимым (p<0,05) увеличением средней длины проростков на 10,1%. На фоне искусственного заражения фузариозом бактеризация штаммом RSA-13 не привела к снижению распространённости инфекции, однако существенно снизила её вредоносность, что проявилось в статистически значимом (p<0,001) увеличении средней длины проростков на 44,1%.
По результатам лабораторных исследований оба штамма были допущены до полевых испытаний на сортах сои местной селекции Эос и Заряница, предназначенных для возделывания в регионе Приенисейской и Восточной Сибири. В ходе полевых испытаний оба штамма статистически значимо снизили интенсивность развития грибных болезней сои в середине вегетационного периода. Более отзывчивым на бактеризацию штаммами-антагонистами оказался сорт Эос, у которого бактеризация штаммами RSA-1 и RSA-13 привела к снижению интенсивности развития болезней в 1,32-1,36 раза. У сорта Заряница снижение интенсивности грибных болезней было менее значительным – в 1,12-1,17 раз. Снижение интенсивности заболеваний в результате обработки штаммами-антагонистами сопровождалось статистически значимым увеличением высоты (на 21-24% в зависимости от варианта) и массы (на 20-35% в зависимости от варианта) растений. Исключение составил вариант “RSA-13 х сорт Заряница”, где увеличение высоты и массы растений было статистически незначимым.
Изучаемые штаммы не оказали негативного влияния на нодуляцию сои, а бактеризация штаммом RSA-1 привела к увеличению числа клубеньков на одно растение у сорта Заряница на 70,5%. Бактеризация обоими штаммами статистически значимо повысила урожайность сои сорта Эос на 36,2-38,8%, а бактеризация штаммом RSA-13, кроме этого, повысила урожайность сои сорта Заряница на 25,9%. Таким образом, оба штамма продемонстрировали высокую эффективность против грибных болезней в сочетании с отсутствием негативного эффекта в отношении нодуляции сои. На основании результатов полевых испытаний штаммы RSA-1 и RSA-13 рекомендуются в качестве биологических средств защиты сои от грибных болезней в условиях Сибири.
Для приготовления пилотных партий биопрепаратов, достаточных для бактеризации нескольких тонн семян сои, нами были разработаны протоколы культивирования и применения штаммов RSA-1 и RSA-13. Протоколы предусматривают выращивание штаммов на агаризованной среде (среда №2 ГРМ в разведении 1:1 либо среда с 20 г/л пептона для штамма RSA-1, среда №2 ГРМ в разведении 1:1 либо среда Чапека-Докса для штамма RSA-13) с последующим смывом для получения споровой суспензии, разбавление суспензии до титра 10 7 спор на мл, и бактеризацию семян полученной суспензией непосредственно перед посевом.
Основные результаты исследований опубликованы в статьях:
Родовиков С.А., Чураков А.А., Попова Н.М., Хижняк С.В. Почвенные микробные сообщества как источник штаммов для биологической защиты сои от фузариоза в Приенисейской Сибири // Вестник Нижневартовского государственного университета. 2020. № 2. С. 4-11. (журнал перечня ВАК, статья проиндексирована в базе Agris FAO)
Rodovikov S.A., Churakov A.A., Popova N.M., Abduraimov P.O., Khizhnyak S.V. Bacterial strains for biological control of fusarium root rot of soybean in Siberia // 2020 IOP Conf. Ser.: Earth Environ. Sci. 548 042054 (издание, индексируемое в базе Scopus).
Чураков А.А., Родовиков С.А., Попова Н.М., Хижняк С.В. Влияние бактериальных штаммов-антагонистов на развитие фузариоза и образование клубеньков у сои // В сборнике: Научно-практические аспекты развития АПК. Материалы национальной научной конференции. Красноярск, 2020. С. 138-141. (статья проиндексирована в РИНЦ)
Родовиков С.А., Овсянкина С.В., Хижняк С.В., Чураков А.А. Перспективы использования автохтонных бактерий для биологической защиты сои от грибных болезней в Приенисейской Сибири // В сборнике: Исследования молодых ученых в биологии и экологии. сборник научных статей по материалам I Международной и XII Региональной научной конференции, посвящённой 75-летию Победы в Великой Отечественной войне. Саратов, 2020. С. 112-114. (статья проиндексирована в РИНЦ)
Профилактическая защита рассады от болезней с умом. Как?
Каждый агроном знает, что залог высокого урожая — здоровая сильная рассада. При этом, именно в рассадный период растение наиболее уязвимо и остро реагирует на нарушения микроклимата, режимов полива, а также воздействию фитопатогенов и вредителей.
На сегодняшний день в большинстве тепличных комбинатов для выращивания растений применяется так называемая малообъемная технология, при которой используются органические (кокос, торф) или неорганические (минеральная вата, перлит, вермикулит) субстраты ограниченного объема. Для успешного выращивания растений в таких условиях одной из главных задач агронома является получение здоровой рассады с сильной корневой системой.
Для выращивания рассады применяются реже кассеты либо минераловатные пробки с последующей пикировкой рассады, но чаще используется прямой посев семян непосредственно в минераловатный или кокосовый кубик. При этом, при прямом посеве семена присыпают, как правило, агровермикулитом.
Агровермикулит
Агровермикулит — природный материал из группы гидрослюд, получаемый путем быстрого высокого нагревания природного материала — вермикулита. За счет этого вермикулит превращается в пористый, сыпучий агровермикулит, который обладает высокой влагоемкостью. При этом агровермикулит обладает другими важными свойствами: биологически устойчив, не гниет, химически инертен по отношению к растениям.
Все эти свойства делают агровермикулит практически незаменимым при выращивании рассады, так как он способствует поддержанию оптимальной влажности семян после посева, оберегает от пересыхания, за счет этого снижается количество поливов рассады. Кроме того, агровермикулит обеспечивает дополнительную защиту семян от внешних факторов, таких как понижение температуры, так как обладает повышенной теплоизоляцией.
При прямом посеве семян в минераловатный или кокосовый кубик, необходимо понимать, что это практически «пустые» как с химической, так и с биологической точки зрения субстраты. Но если использование поливных растворов с полным комплексом минеральных компонентов, необходимых для роста и развития растения, вещь сама собой разумеющаяся, то обеспечение в прикорневой зоне растения полезного биоценоза микроорганизмов с первого дня посева и прорастания семян понимание находит не у всех специалистов.
Важно понимать, что в процессе своего роста и развития, начиная с момента прорастания из семени, растение выделяет через корневую систему так называемые экссудаты. Это сложные, уникальные для каждого растения, по своему составу выделения органической природы, в состав которых входят органические кислоты, сахара, аминокислоты, ферменты, гормоны и витамины. Все эти компоненты являются отличным источником питания для микроорганизмов, как полезных, так и фитопатогенных для растений.
Технологии
Очевиден вопрос: откуда появятся микроорганизмы, если рассадный кубик состоит из инертного материала и по сути должен быть стерилен. В большей степени это так. Но абсолютно стерильных поверхностей не бывает, микроорганизмы могут попадать в процессе транспортировки и хранения, а также переноситься через воздух, на одежде и руках. Если учитывать, что в теплице фитопатогенный фон, как правило, высокий, то вероятность попадания микроорганизмов в рассаду высок. Более того, широко распространена семенная инфекция, когда фитопатогены присутствуют с самого начала на поверхности или внутри семени. А циркуляция поливного раствора в рассадном отделении увеличивает риск широкого распространения патогенов от растения к растению.
Поэтому, для того, чтобы снизить риск возникновения и развития фитопатогенных микроорганизмов в корневой и прикорневой зонах растений с самого начала необходимо дополнительное профилактическое внесение биопрепаратов. При этом важно, чтобы микроорганизмы попали и задержались именно в корневой зоне, где есть источник питания для микроорганизмов (экссудаты). Для этого, как правило, применяется либо замачивание семян перед посевом в растворе биопрепаратов, либо пролив кубиков рабочим раствором биопрепаратов после посева семян.
Каждый из этих способов имеет свои достоинства и недостатки. Замачивание семян в растворе биопрепаратов обеспечивает высокую концентрацию полезных микроорганизмов непосредственно на семени, в то время как при проливе кубика рабочим раствором биопрепаратов микроорганизмы распределяются равномерно по всему объему кубика и их количество на семени будет меньше, чем при замачивании. При этом в каждом случае микроорганизмы будут находится в жидком состоянии, а это значит, что в течение короткого времени — от нескольких часов до суток (в зависимости от вида микроорганизма), перейдут в активную фазу своего развития. При этом, в окружающей среде (кубике) к этому времени не успеет накопиться корневых выделений в достаточном количестве для развития полезных микроорганизмов и часть их может погибнуть, так как других источников питания в субстрате практически нет.
Одновременно, нужно понимать какие именно микроорганизмы будут наиболее эффективны и полезны в рассадный период.
На сегодняшний день в биологических фунгицидах в качестве действующего начала хорошо изучены и применяются всего несколько групп микроорганизмов и продукты их жизнедеятельности: бактерии рода Bacillus sp. (чаще Bacillus subtilis) и Pseudomonas sp, грибы рода Trichoderma sp. и Gliocladium sp.
Биопрепараты на основе бактерий Bacillus subtilis, а так же грибов рода Trichoderma sp., Gliocladium sp. не могут быть высокоэффективными для применения в рассадный период в силу специфики своей биологической активности.
Бактерии Bacillus subtilis проявляют максимальную биологическую эффективность только в момент перехода из спорового состояния в вегетативную клетку. В этот момент происходит выделение огромного спектра метаболитов (антибиотики, ферменты, кислоты и т.д.), которые убивают практически все микроорганизмы вокруг. Эффект этот длится в среднем около 48 часов. Далее вегетативная клетка не выделяет большого количества биологически активных веществ, способных проявлять высокую фитопатогенную активность. При посеве семян за первые 48 часов не успевает накопиться и развиться большой фитопатогенный фон, поэтому применение препаратов на основе бактерий Bacillus subtilis, по большому счету, совершенно бесполезно.
Препараты на основе грибных культур, таких как Trichoderma sp. и Gliocladium sp.более эффективны в рассадный период, чем препараты на основе бактерий Bacillus subtilis. Эти грибы обладают высокой фитопатогенной активностью только против грибных заболеваний. Но при недостаточном количестве питания во внешней среде могут начать паразитировать на растении, поэтому применять такие препараты эффективнее и надежнее, когда растение уже взрослое и окрепшее.
Бактерии Pseudomonas sp. являются естественным почвенным обитателем, при этом, развиваясь в корневой зоне колонизирует корневую систему растения по всей длине и не пускает и подавляет патогенные микроорганизмы вокруг. Из всех широко изученных и используемых в качестве действующих веществ биопрепаратов микроорганизмов, как бактерий, так и грибов, данные качества: фунгицидные и ростостимулирующие свойства, а так же высокое сродство к корневой системе растений сочетают в себе только бактерии Pseudomonas sp.
При этом многие виды бактерий Pseudomonas sp. в процессе своей жизнедеятельности выделяет вещества гиббереллинового ряда, которые обладают высоким ростостимулирующим эффектом.
Витариз
Руководствуясь этими уникальными свойствами бактерий Pseudomonas sp., а так же учитывая проблемы применения обычных биопрепаратов на рассаде, было группой компаний «БИОМ» разработано биологическое средство ВИТАРИЗ (АгровермикулитБИО) на основе бактерии Pseudomonas fluorescens и агровермикулита.
ВИТАРИЗ (АгровермикулитБИО) — высокоэффективное биологическое средство, специально разработанное и предназначенное для выращивания растений в рассадный период. Представляет собой агровермикулит фракцией 2 мм с нанесенными на поверхность по специальной технологии живыми клетками бактерий Pseudomonas fluorescens и органическими компонентами.
Преимущества ВИТАРИЗа состоит в том, что средство сочетает в себе описанные выше агрохимические свойства агровермикулита и биологические свойства бактерии Pseudomonas fluorescens. При применении ВИТАРИЗа нет необходимости дополнительного внесения каких либо препаратов после посева для защиты рассады: достаточно стандартного агрономического приема — присыпки семени агровермикулитом, для достижения дружных всходов и здоровой рассады с сильной корневой системой. При соблюдении всех карантинных мероприятий и агрономических и агрохимических режимов при выращивании рассады однократного внесения ВИТАРИЗа в качестве единственного средства для профилактики возникновения и развития заболеваний на рассаде достаточно в течение всего рассадного периода пребывания в рассадном отделении.
Бактерии Pseudomonas fluorescens уникальны еще и тем, что они способны метаболизировать остатки фенольных соединений, которые могут образовываться в процессе производства и присутствовать в минеральной вате, реже торфе и кокосе. При этом достаточно минимального количества веществ данной группы, чтобы вызвать массовые ожоги листовой поверхности и угнетение роста на рассаде. Многолетним опытом использования ВИТАРИЗа доказано, что при его применении риск возникновения «фенольных отравлений» в рассадный период становится минимальным при применении субстрата любого производителя.
Источник https://apknet.ru/razrabotka-biopreparata-dlya-zashhity-soi-ot-gribnyx-boleznej-v-usloviyax-sibiri/
Источник https://www.biom-group.ru/blog/profilakticheskaya-zashchita-rassady-ot-bolezney-s-umom-kak/
Источник
Источник